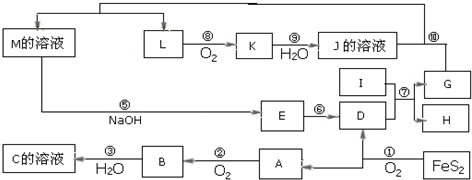
题目内容
18.研究CO2的利用对促进低碳社会的构建具有重要的意义.(1)已知石墨的标准燃烧热为y kJ•mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量,则石墨与氧气反应生成CO的热化学方程式为C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-(20x-y)kJ•mol-1.
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①该反应的平衡常数表达式为K=$\frac{C(CH{\;}_{3}OH)C(H{\;}_{2}O)}{C(CO{\;}_{2})C{\;}^{3}(H{\;}_{2})}$.
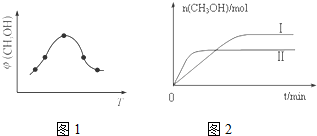
②取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图1所示,则上述CO2转化为甲醇反应的△H<(填“>”“<”或“=”)0.
③在两种不同温度下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>”“<”或“=”).
④一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2 3molH2 | a molCO2、b molH2、c molCH3OH(g)、c molH2O(g) (a、b、c均不等于0) |
分析 (1)1.2g石墨的物质的量为n(C)=$\frac{1.2g}{12g/mol}$=0.1mol,1.68L氧气的物质的量为n(O2)=$\frac{1.68L}{22.4L/mol}$=0.075mol,生成物为CO和CO2的混合物,设生成CO的物质的量为nmol,由C元素守恒得CO2的物质的量为(0.1-n)mol,根据关系式nC~n$\frac{1}{2}$O2~nCO,(0.1-n)O2~(0.1-n)CO2,则$\frac{1}{2}$n+(0.1-n)=0.075,n=0.05,所以反应后生成0.05molCO,0.05molCO2,根据反应放出的总热量x kJ和1mol石墨完全燃烧放出y kJ(y>0)的热量,可计算出生成0.05molCO放出的热量,进而求出反应的热化学方程式.
(2)①根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,
②根据到达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行;
③根据先拐先平数值大原则,由图1可知,温度TⅠ<TⅡ,平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,据此判断反应热,KⅠ与KⅡ关系;
④根据平衡三部曲求出甲中平衡时各气体的物质的量,然后根据平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行来判断范围.
解答 解:(1)1.2g石墨的物质的量为n(C)=$\frac{1.2g}{12g/mol}$=0.1mol,1.68L氧气的物质的量为n(O2)=$\frac{1.68L}{22.4L/mol}$=0.075mol,生成物为CO和CO2的混合物,设生成CO的物质的量为nmol,由C元素守恒得CO2的物质的量为(0.1-n)mol,根据关系式nC~n$\frac{1}{2}$O2~nCO,(0.1-n)O2~(0.1-n)CO2,则$\frac{1}{2}$n+(0.1-n)=0.075,n=0.05,所以反应后生成0.05molCO,0.05molCO2,1mol石墨完全燃烧放出ykJ(y>0)的热量,所以生成0.05molCO2放出的热量为0.05yKJ,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量.则生成0.05molCO放出的热量为(x-0.05y)kJ,所以生成1molCO放出的热量为$\frac{x-0.05y}{0.05}$kJ,即(20x-y)kJ,所以热化学方程式为:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-(20x-y)kJ•mol-1,
故答案为:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-(20x-y)kJ•mol-1;
(2)①平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K=$\frac{C(CH{\;}_{3}OH)C(H{\;}_{2}O)}{C(CO{\;}_{2})C{\;}^{3}(H{\;}_{2})}$,故答案为:$\frac{C(CH{\;}_{3}OH)C(H{\;}_{2}O)}{C(CO{\;}_{2})C{\;}^{3}(H{\;}_{2})}$;
②由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H<0.故答案为:<;
③由图2先拐先平衡温度高可知,温度TⅠ<TⅡ,平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,故该反应正反应为放热反应,则△H<0,升高温度,平衡向逆反应移动,所以KⅠ>KⅡ,故答案为:>;
④CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始:1 3 0 0
平衡:1-x 3-3x x x
甲中平衡后气体的压强为开始时的0.8倍,即$\frac{4-2x}{4}$=0.8
解得x=0.4mol
依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量为1mol,c 的物质的量不能低于平衡时的物质的量0.4mol,所以c的物质的量为:0.4<n(c)≤1mol,故答案为:0.4<n(c)≤1mol.
点评 本题考查涉及知识点较多,涉及平衡常数的计算、平衡状态的判断以及外界条件对平衡移动的影响等问题,题目难度中等,本题注意把握计算方法以及平衡常数的运用.

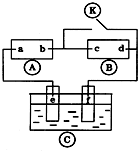 如图
如图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A. | a为直流电源的负极 | B. | c极发生的反应为2H++2e-=H2↑ | ||
| C. | f电极为锌板 | D. |  中溶液的溶质为FeSO4 中溶液的溶质为FeSO4 |
| A. | Cl2 | B. | HCl | C. | SO2 | D. | CO2 |
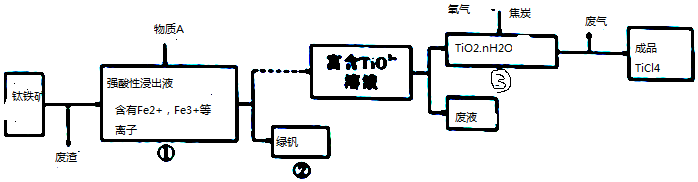
(1)FeTiO3中,Ti元素的化合价为+4.
(2)往①中加入的物质A是Fe.
(3)②中的绿矾带有棕黄色,原因可能是含有Fe3+;设计实验证明Fe3+杂质离子的存在取样,溶于水,向溶液中加入KSCN溶液,如果溶液变为血红色,证明含有Fe3+;
(4)写出③中TiO2和过量焦炭、氯气在高温下反应的化学方程式:TiO2+2C+Cl2$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.
(5)用金属Mg还原成品TiO4得到Mg、MgCl2和Ti的混合物,再真空蒸馏制备Ti. 依据下表,蒸馏温度略高于1412℃即可.
| Mg | MgCl2 | Ti | |
| 熔点/℃ | 648.0 | 714 | 1667 |
| 沸点/℃ | 1090 | 1412 | 3287 |
(7)向含有Fe2+、Fe3+溶液加入适量KOH和油脂,在高速撞拌下得到磁流体材料KxFeO2.
①若x=l.请写出在酸性条件下KxFeO2溶液与足量KI溶液反应的离子方程式:8H++2FeO2-+2I-=2Fe2++I2+4H2O.
②磁流体材料KxFeO2在组成上可理解为aK2O•bFeO•cFe2O3,若x=1.3,则b:c=6:7.
| A. | 1mol S(g) 与1mol O2(g)的总能量比1mol SO2(g)的总能量低Q kJ | |
| B. | 1mol S(g) 与1mol O2(g)反应生成1mol SO2(g)放出Q kJ 的能量 | |
| C. | S(s)+O2(g)═SO2(g)△H<-Q kJ•mol-1 | |
| D. | 1个 S(g) 与1个 O2(g)完全反应可放出 Q kJ的能量 |
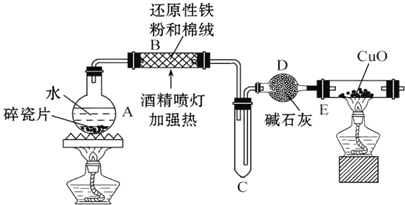 某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题: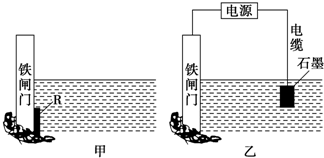 下面两个图都是金属防护的例子.
下面两个图都是金属防护的例子.