题目内容
3.某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如图所示装置.打开分液漏斗D中活塞,缓慢加入稀盐酸至过量,与固体M充分反应.待反应停止后,B中有黑色沉淀析出,C中量气装置右边液面上升,调节量气装置使左右液面相平后,测得进入C中的气体为V mL(已换算成标准状况).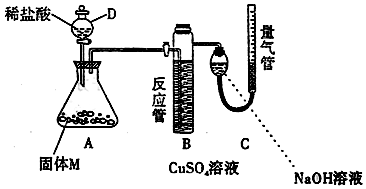
根据上述实验事实,回答下列问题:
(1)加入药品和实验开始前必须进行的操作是检查装置的气密性.
(2)固体M中一定有的物质是FeS、Fe(写化学式).
(3)写出A中发生反应的化学方程式(只写一个):FeS+2HCl═FeCl2+H2S↑或Fe+2HCl═FeCl2+H2↑.
(4)写出B中析出黑色沉淀时发生反应的离子方程式Cu2++H2S═CuS↓+2H+.
(5)根据题给条件,固体M中一种物质的质量可以确定,应为m(铁)=$\frac{56V}{22400}$g(用代数式表示).
(6)稀盐酸与固体M反应后还残留淡黄色固体,该固体可能是S(写化学式),要分离该固体,在实验操作中,除烧杯、玻璃棒外,还需要的玻璃仪器是漏斗.
(7)反应完成后,取A中溶液少许加入试管中,要确定固体M中是否含有Fe3+,需加入的试剂为:A.
A.KSCN溶液B.NaOH溶液C.氨水.
分析 铁和硫在隔绝空气的情况下反应生成FeS,故固体混合物M可能为FeS、S或FeS、Fe,加入盐酸,一定发生FeS+2HCl═FeCl2+H2S↑,可能发生Fe+2HCl═FeCl2+H2↑,B中析出黑色沉淀,应为CuS,说明生成H2S,量气装置C中氢氧化钠可用于吸收H2S,C中量气装置右边液面上升,调节量气装置使左右液面相平后,测得进入C中的气体为V mL,说明生成氢气,则说明混合物为FeS、Fe,可根据氢气的体积确定铁的质量,以此解答该题.
解答 解:(1)加入药品和实验开始前必须进行的操作是检查装置的气密性,故答案为:检查装置的气密性;
(2)因为B中有黑色沉淀析出,说明生成H2S,则发生发生FeS+2HCl═FeCl2+H2S↑,C中量气装置右边液面上升,说明生成氢气,则发生生Fe+2HCl═FeCl2+H2↑,所以固体M中一定有的物质是FeS、Fe,故答案为:FeS、Fe;
(3)根据以上分析,固体混合物M中一定有的物质是FeS、Fe,A中加入盐酸,发生FeS+2HCl═FeCl2+H2S↑和Fe+2HCl═FeCl2+H2↑,
故答案为:FeS+2HCl═FeCl2+H2S↑或Fe+2HCl═FeCl2+H2↑;
(4)B中析出黑色沉淀,应为CuS,反应的离子方程式为Cu2++H2S═CuS↓+2H+,故答案为:Cu2++H2S═CuS↓+2H+;
(5)C中量气装置右边液面上升,调节量气装置使左右液面相平后,测得进入C中的气体为V mL,说明生成氢气体积为V,则n(Fe)=n(H2)=$\frac{V×10{\;}^{-3}L}{22.4L/mol}$,m(Fe)=$\frac{V×10{\;}^{-3}L}{22.4L/mol}$×56g/mol=$\frac{56V}{22400}$g,
故答案为:m(铁)=$\frac{56V}{22400}$;
(6)稀盐酸与固体M反应后还残留淡黄色固体,该固体是硫,硫不溶于水,故可采取过滤方法分离,过滤所需仪器为烧杯、漏斗、玻璃棒;故答案为:S;漏斗;
(7)要确定固体M中是否含有Fe3+,根据三价铁与KSCN溶液显血红色检验,所以需加入的试剂为KSCN溶液,故选:A.
点评 本题综合考查物质的含量测定,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握实验的原理和操作方法,结合物质的性质解答,难度中等.

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案| A. | 硫化钠的水解反应:S2-+H3O+═HS-+H2O | |
| B. | 等物质的量的溴化亚铁跟氯气反应:Fe2++2Br-+C12═Fe3++Br2+2Cl- | |
| C. | 向NaHSO3溶液中加人少量Ba(OH)2溶液:2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O | |
| D. | 将Fe2O3溶于氢碘酸中:Fe2O3+6H+═2Fe3++3H2O |
| A. | H2O | B. | Zn | C. | KCl | D. | KI |
| A. | Fe2O3固体中加入HI溶液:Fe2O3+6H+═2Fe3++3H2O | |
| B. | NaAlO2溶液和NaHCO3溶液混合:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- | |
| C. | 碳酸氢钙溶液中加入少量澄清石灰水:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O | |
| D. | NaOH和Ba(OH)2混合溶液中通入少量CO2:2OH-+CO2═CO32-+H2O |
| A. | 食用加碘盐可预防碘缺乏症,加碘盐中加的含碘物质是碘单质 | |
| B. | 因为NaCl的水溶液能导电,所以NaCl溶液属于强电解质 | |
| C. | 电解熔融NaCl得到23.0g金属钠时能产生22.4 L氯气(标准状况下) | |
| D. | 37Cl 是氯元素的一种同位素,23Na37Cl中质子数和中子数之比是7:8 |
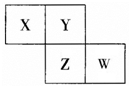 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,已知W原子的最外层电子数比内层电子数少3 个,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,已知W原子的最外层电子数比内层电子数少3 个,下列说法正确的是( )| A. | 氧化物对应水化物酸性W比Z强 | |
| B. | Y单质与Z的氢化物水溶液反应,有沉淀生成 | |
| C. | X单质氧化性强于Y单质 | |
| D. | 简单离子的半径:Z<W |
 某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.请回答:
某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.请回答: 向100mL 3mol•L-1硫酸铝铵【NH4Al(SO4)2】溶液中逐滴加入1mol•L-1Ba(OH)2溶液.
向100mL 3mol•L-1硫酸铝铵【NH4Al(SO4)2】溶液中逐滴加入1mol•L-1Ba(OH)2溶液.