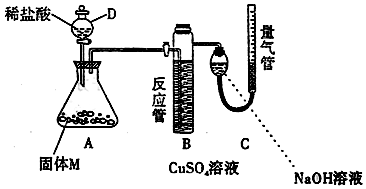
题目内容
1.下列有关反应的离子方程式的书写,正确的是( )| A. | 硫化钠的水解反应:S2-+H3O+═HS-+H2O | |
| B. | 等物质的量的溴化亚铁跟氯气反应:Fe2++2Br-+C12═Fe3++Br2+2Cl- | |
| C. | 向NaHSO3溶液中加人少量Ba(OH)2溶液:2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O | |
| D. | 将Fe2O3溶于氢碘酸中:Fe2O3+6H+═2Fe3++3H2O |
分析 A.硫离子水解生成硫氢根离子和氢氧根离子,题中反应为硫离子与少量酸的反应;
B.亚铁离子的还原性强于溴离子,氯气先和亚铁离子反应,再和溴离子反应;
C.氢氧化钡少量,离子方程式按照氢氧化钡的组成书写;
D.铁离子能够将碘离子氧化成碘单质.
解答 解:A.S2-+H3O+═HS-+H2O不是水解反应,硫离子水解生成硫氢根离子和氢氧根离子,正确的水解反应为:S2-+H2O═HS-+OH-,故A错误;
B.等物质的量的溴化亚铁跟氯气反应,亚铁离子的还原性大于溴离子,则亚铁离子优先被氧化,正确的反应为:2Fe2++2Br-+2C12═2Fe3++Br2+4Cl-,故B错误;
C.向NaHSO3溶液中加人少量Ba(OH)2溶液,反应生成亚硫酸钡、亚硫酸钠和水,反应的离子方程式为:2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O,故C正确;
D.将Fe2O3溶于氢碘酸中,二者发生氧化还原反应,正确的离子方程式为:Fe2O3+6H++2I-=2Fe2++I2+3H2O,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度中等,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等;试题培养了学生的灵活应用能力.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
11.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术,制取Na2FeO4的反应为:Fe2O3+3Na2O2=2Na2FeO4+Na2O,下列说法不正确的是( )
| A. | Fe2O3是反应的还原剂 | |
| B. | Na2O2既是氧化剂又是还原剂 | |
| C. | Na2FeO4是反应的氧化产物 | |
| D. | 氧化剂与还原剂的物质的量的比是3:1 |
9.下列说法正确的是( )
| A. | 煤、石油、天然气均为化石燃料,它们属于可再生资源 | |
| B. | 大自然利用太阳能最成功的是植物的光合作用 | |
| C. | 石油的分馏、催化裂化、裂解等石油加工方法,其目的均为得到更多的汽油 | |
| D. | 化肥的大量使用不会造成环境污染 |
16.为了除去硫酸铜溶液中含有的Fe2+杂质,先加入合适的氧化剂使Fe2+氧化为Fe3+,然后再调节溶液的pH值,下列物质中最好选用( )
| A. | Cl2水,NaOH(aq) | B. | KMnO4(aq),氨水 | C. | H2O2溶液,氧化铜 | D. | HNO3(aq),氨水 |
5.为减轻大气污染,可在汽车尾气排放处加装催化转化装置,反应方程式为:2NO(g)+2CO(g)$?_{△}^{催化剂}$2CO2(g)+N2(g).
(1)上述反应使用等质量的某种催化剂时,温度和催化剂的比表面积对化学反应速率的影响对比实验如下表,c(NO)浓度随时间(t)变化曲线如图:
①表中a=1.20×10-3.
②实验说明,该反应是放热反应(填“放热”或“吸热”).
③若在500℃时,投料$\frac{{c({NO})}}{{c({CO})}}=1$,NO的转化率为80%,则此温度时的平衡常数K=第一种情况:设c(NO)=1mol•L-1,则K=160,
第二种情况:设c(NO)=amol•L-1,K=$\frac{160}{a}$,
第三种情况:设n(NO)=amol,容器的容积为V L,则K=$\frac{160V}{a}$.
(2)使用电化学法也可处理NO的污染,装置如图2.已知电解池阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:2HSO3-+2H++2e-=S2O42-+2H2O.吸收池中除去NO的离子方程式为:2NO+2S2O42-+2H2O=N2+4HSO3-.
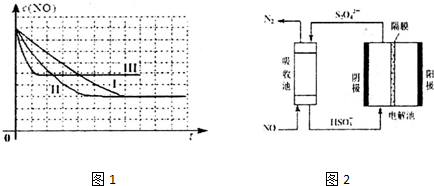
(1)上述反应使用等质量的某种催化剂时,温度和催化剂的比表面积对化学反应速率的影响对比实验如下表,c(NO)浓度随时间(t)变化曲线如图:
| 编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | a | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | b |
②实验说明,该反应是放热反应(填“放热”或“吸热”).
③若在500℃时,投料$\frac{{c({NO})}}{{c({CO})}}=1$,NO的转化率为80%,则此温度时的平衡常数K=第一种情况:设c(NO)=1mol•L-1,则K=160,
第二种情况:设c(NO)=amol•L-1,K=$\frac{160}{a}$,
第三种情况:设n(NO)=amol,容器的容积为V L,则K=$\frac{160V}{a}$.
(2)使用电化学法也可处理NO的污染,装置如图2.已知电解池阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:2HSO3-+2H++2e-=S2O42-+2H2O.吸收池中除去NO的离子方程式为:2NO+2S2O42-+2H2O=N2+4HSO3-.

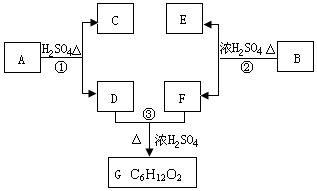 A、B、C、D、E、F和G都是有机化合物,它们的关系如图所示:
A、B、C、D、E、F和G都是有机化合物,它们的关系如图所示: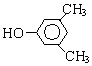 或
或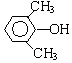 或
或 (写出一种即可).
(写出一种即可). 或
或
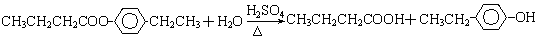 .①反应的反应类型取代反应
.①反应的反应类型取代反应 或
或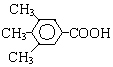 .
.