��Ŀ����
19�����෨��һ����֮��Ч�������еĿ�ѧ�����������й����ʷ���������ȷ���� ���������ٻ���Ư�ۡ���ˮ��Fe��OH��3���塢��ˮ�����
�ڻ����CaCl2��NaOH��HCI��HT
��ͬ�������壺C60��̼���ܡ����ʯ��ʯī
�ܵ���ʣ�������̼�ᱵ�������ᡢ������
��ú�ĸ���ú��������ú��Һ�������ڻ�ѧ�仯
�����Σ��մɡ���оƬ��������ˮ�࣮
| A�� | �٢ڢ� | B�� | �ۢ� | C�� | �ۢܢ� | D�� | �ۢܢ� |
���� �������ֻ��������ʹ��ɵ�Ϊ����
�������ֻ���������Ԫ���γɵĴ�����Ϊ�����
��ͬ��Ԫ���γɵIJ�ͬ�ֵ��ʼ以Ϊͬ�������壻
����ˮ��Һ�л�����״̬���ܵ���Ļ�����Ϊ����ʣ�
��ú�ĸ����ǽ�ú����������ǿ��ʹ��ֽ�Ĺ��̣�ú����������ú����ˮú����ú��Һ������ú�����״���
���������ǽ������ӻ�笠����ӡ�������Ϊ������Ļ�����Ϊ�����Σ�
��� �⣺�������ֻ��������ʹ��ɵ�Ϊ�������б�Ϊ����ˮ���ʱ�ˮ�����Ϊ������ʢٴ���
�������ֻ���������Ԫ���γɵĴ�����Ϊ�������HT����һ��Ԫ���γɵģ���Ϊ���ʣ��ʢڴ���
��ͬ��Ԫ���γɵIJ�ͬ�ֵ��ʼ以Ϊͬ�������壬C60��̼���ܡ����ʯ��ʯī��Ϊ̼Ԫ���γɵIJ�ͬ��̼���ʣ��ʻ�Ϊͬ�������壬�ʢ���ȷ��
����ˮ��Һ�л�����״̬���ܵ���Ļ�����Ϊ����ʣ������ᡢ��Ρ������������ˮ�ȣ��ʵ��������ᱵ�������ᡢ�����ؾ�Ϊ����ʣ��ʢ���ȷ��
��ú�ĸ����ǽ�ú����������ǿ��ʹ��ֽ�Ĺ��̣�ú����������ú����ˮú����ú��Һ������ú�����״�����ú�ĸ���������Һ����Ϊ��ѧ�仯���ʢ���ȷ��
���������ǽ������ӻ�笠����ӡ�������Ϊ������Ļ�����Ϊ�����Σ��մɡ�������ˮ�࣬��оƬ����Ҫ�ɷ־�Ϊ�裬�ʲ��ǹ����Σ��ʢ���
��ѡB��
���� �����ۺϿ�����ú���ۺ����á�ͬ��������ĸ���ͱ����������ʹ����������ȣ���Ŀ�ѶȲ���ע����������գ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�| A�� | SiO2������1����ԭ�Ӻ�2����ԭ����� | |
| B�� | ˮ������Ҫ�ɷ��ǵ��ʹ� | |
| C�� | ̫���ܵ�ؿɲ���SiO2��������Ӧ�������ڽ��ܡ����� | |
| D�� | ˮ�����������ϼ���ľ�ķ���� |
| A�� | NaCl��Һ | B�� | Fe��OH��3���� | C�� | ���� | D�� | CuSO4��Һ |
| A�� | �϶�����I- | B�� | �϶�����NH4+ | C�� | ���ܺ���SO32- | D�� | �϶�����SO42- |
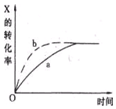 ��ͼ����a��ʾ���ȷ�ӦX��g��+Y��g��?Z��g��+M��g��+N��s�����й�����X��ת������ʱ��仯�Ĺ�ϵ����Ҫ�ı���ʼ������ʹ��Ӧ���̰�b���߽��У��ɲ�ȡ�Ĵ�ʩ�ǣ�������
��ͼ����a��ʾ���ȷ�ӦX��g��+Y��g��?Z��g��+M��g��+N��s�����й�����X��ת������ʱ��仯�Ĺ�ϵ����Ҫ�ı���ʼ������ʹ��Ӧ���̰�b���߽��У��ɲ�ȡ�Ĵ�ʩ�ǣ�������| A�� | ��ѹ | B�� | �Ӵ�X��Ͷ���� | C�� | �����¶� | D�� | ��С��� |
 ��һ����1����ѧʽΪC6Hm��������mֵ����14����д��HCl�ĵ���ʽ
��һ����1����ѧʽΪC6Hm��������mֵ����14����д��HCl�ĵ���ʽ ��
�����������ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã�ͼ��N2��g����H2��g����Ӧ����1mol NH3��g�������������仯ʾ��ͼ��
��2����д��N2��H2��Ӧ���Ȼ�ѧ����ʽ��N2��g��+3H2��g��=2NH3��g����H=-92.2KJ/mol��
��3������֪�������ݣ�
| ��ѧ�� | H-H | N��N |
| ����/kJ•mol-1 | 435 | 943 |
��4���ϳɰ���Ӧͨ��������ý��������ʹ������ý��E1�仯�ǣ�E1��С �����������С���������䡱����
��5����NH3����ԭNOX���������������������Ⱦ������
4NH3��g��+3O2��g��?2N2��g��+6H2O��g����H1=akJ•mol-1
N2��g��+O2��g��?2NO��g����H2=b kJ•mol-1
��1mol NH3��ԭNO��N2����÷�Ӧ�����еķ�Ӧ�ȡ�H3=$\frac{a-3b}{4}$kJ/mol���ú�a��b��ʽ�ӱ�ʾ��
| A�� | ��طŵ�ʱͨ������ĵ缫Ϊ���� | |
| B�� | ����CO32-ˮ���Լ��ԣ���طŵ�ʱ���������Һ��pH������ | |
| C�� | ��طŵ�ʱ�����ĵ缫��ӦʽΪCH3OH+8OH--6e-�TCO32-+6H2O | |
| D�� | ��طŵ�ʱÿ����1 mol CH3OHת��8 mol���� |
 �ж���ͼװ�õ����ƣ�B��Ϊ���أ��ԭ��ء����ء�����C2������224mL���壨��״����ʱ��п���������٣�����ӡ����١�����
�ж���ͼװ�õ����ƣ�B��Ϊ���أ��ԭ��ء����ء�����C2������224mL���壨��״����ʱ��п���������٣�����ӡ����١�����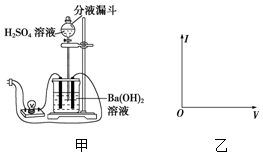 ʹ����ѧ���õ�ʵ�����ģ����һ��ʵ��۲�Ba��OH��2��H2SO4����Һ�еķ�Ӧ�����Եı仯�����ش����⣺
ʹ����ѧ���õ�ʵ�����ģ����һ��ʵ��۲�Ba��OH��2��H2SO4����Һ�еķ�Ӧ�����Եı仯�����ش����⣺