题目内容
10.当光束通过下列分散系时,可能产生丁达尔效应的是( )| A. | NaCl溶液 | B. | Fe(OH)3胶体 | C. | 盐酸 | D. | CuSO4溶液 |
分析 丁达尔效应是指:当一束光线透过胶体,从入射光的垂直方向可以观察到胶体里出现的一条光亮的“通路.丁达尔现象是胶体特有的性质.
解答 解:NaCl溶液、盐酸、硫酸铜溶液都是溶质的水溶液,当光束通过时无此现象,Fe(OH)3胶体,当光束通过时会产生丁达尔现象,
故选:B.
点评 本题考查了胶体的性质应用,注意丁达尔效应是胶体特有的性质是解答本题的关键,题目较简单.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
20.把下列四种x溶液分别加入盛有100mL2mol/L盐酸的烧杯中,并加入水稀释至100mL,此时x和盐酸缓缓地进行反应,其中反应速率最大的是( )
| A. | 10℃20 mL3mol/L的x溶液 | B. | 20℃30 mL2mol/L的x溶液 | ||
| C. | 10℃10 mL4mol/L的x溶液 | D. | 10℃20 mL2mol/L的x溶液 |
1.化学与生活、社会发展息息相关,下列有关说法不正确的是( )
| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| B. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| C. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| D. | 向豆浆中加入盐卤(主要成分为MgCl2)可制作豆腐,利用了胶体聚沉的性质 |
2.下列说法中,不正确的是( )
| A. | 管道施工中,不能将铁制自来水管与铜制水龙头连接 | |
| B. | 化学反应过程中,一定有物质的变化,不一定有能量的变化 | |
| C. | 在配制的硫酸亚铁溶液中常加入一定量的铁粉和硫酸 | |
| D. | 已知C(石墨,s)═C(金刚石,s )△H>0,则石墨比金刚石稳定 |
19.短周期主族元素X、Y、Z、W的原子序数依次增大.X是地壳中含量最高的元素,Y+与X2-具有相同的电子层结构,Y与Z位于相邻主族,W与X同主族.下列说法正确的是( )
| A. | W的氢化物比X的氢化物稳定 | |
| B. | Y在周期表中的位置为第3周期、IB族 | |
| C. | Z的最高价氧化物对应的水化物的碱性比Y的弱 | |
| D. | X的单质与含W化合物不可能发生置换反应 |
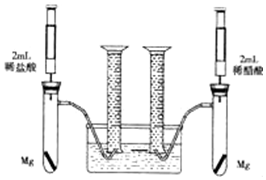 某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)
某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)