题目内容
9.下列关于硅及其化合物的表述正确的是( )| A. | SiO2分子由1个硅原子和2个氧原子组成 | |
| B. | 水晶的主要成分是单质硅 | |
| C. | 太阳能电池可采用SiO2制作,其应用有利于节能、环保 | |
| D. | 水玻璃可用作黏合剂和木材防火剂 |
分析 A、二氧化硅不是分子;
B、水晶的成份是二氧化硅;
C、太阳能电池可采用Si制作,而不是二氧化硅;
D、硅酸钠具有粘性,用来制备硅胶.
解答 解:A、二氧化硅不是分子,硅和氧的原子个数比为1:2,故A错误;
B、水晶的成份是二氧化硅,而不是单质硅,故B错误;
C、太阳能电池可采用Si制作,而不是二氧化硅,故C错误;
D、硅酸钠具有粘性,用来制备硅胶和木材防火剂的原料,故D正确;
故选D.
点评 本题考查硅和二氧化硅的性质,题目难度不大,注意基础知识的积累.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
6.下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | SO2溶于水形成的溶液能导电 | SO2是电解质 |
| B | 白磷为正四面体分子 | 白磷分子中P-P键的键角是109.5° |
| C | 1体积水可以溶解700体积氨气 | 氨是极性分子且由于有氢键的影响 |
| D | HF的沸点高于HCI | H-F的键长比H-CI的键长短 |
| A. | SO2溶于水形成的溶液能导电SO2是电解质 | |
| B. | 白磷为正四面体分子白磷分子中P-P键的键角是109.5° | |
| C. | 1体积水可以溶解700体积氨气氨是极性分子且由于有氢键的影响 | |
| D. | HF的沸点高于HCIH-F的键长比H-CI的键长短 |
20.把下列四种x溶液分别加入盛有100mL2mol/L盐酸的烧杯中,并加入水稀释至100mL,此时x和盐酸缓缓地进行反应,其中反应速率最大的是( )
| A. | 10℃20 mL3mol/L的x溶液 | B. | 20℃30 mL2mol/L的x溶液 | ||
| C. | 10℃10 mL4mol/L的x溶液 | D. | 10℃20 mL2mol/L的x溶液 |
17.下列实验操作中错误的是( )
| A. | 蒸馏操作时,冷凝水的方向应当由下往上 | |
| B. | 分液操作时,首先要打开分液漏斗的上口活塞,或使活塞上的凹槽与上口部的小孔对准,然后进行分液 | |
| C. | 萃取分液后,要得到被萃取的物质,通常还要进行蒸馏 | |
| D. | 提取碘水中的碘单质时,应选择有机萃取剂如乙酸 |
4.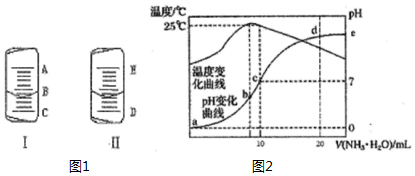 (1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.
(1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.
(2)如图1中的图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)D.
A.是amLB.是(50-a)mL C.-定大于amLD.一定大于(50-a)mL
(3)某校化学兴趣小组的同学用0.1000mol•L-1的NaOH标准溶液对一含有少量杂质(杂质不参与反应)的冰醋酸进行测定,回答下列问题:
①用分析天平准确称取该样品2.500g,全部溶于水配制成250mL的溶液,量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,等待测定,该中和滴定中可选用的指示剂是酚酞,滴定终点的现象是当最后一滴NaOH溶液滴入时,待测液由无色变为粉红色,且半分钟内颜色不恢复.
②用0.10mol•L-1的NaOH标准溶液滴定进行滴定,实验数据如表所示,
计算样品中冰醋酸的质量百分含量为72%.
③若读酸式滴定管读数时,滴定前仰视读数,滴定正确读数,则所测结果偏大;
(4)在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如下图所示,回答下列问题:
①a,b,c,d四点所对应的溶液中,水的电离程度由小到大的顺序为a<d<c<b(用“<”连接)
②c点的 c(NH4+ )=0.5mol•L-1
③请结合图2中信息及题目中数据,用含有n的式子列出Kb(NH3•H2O)的表达式(n-1)×10-7.
 (1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.
(1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.(2)如图1中的图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)D.
A.是amLB.是(50-a)mL C.-定大于amLD.一定大于(50-a)mL
(3)某校化学兴趣小组的同学用0.1000mol•L-1的NaOH标准溶液对一含有少量杂质(杂质不参与反应)的冰醋酸进行测定,回答下列问题:
①用分析天平准确称取该样品2.500g,全部溶于水配制成250mL的溶液,量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,等待测定,该中和滴定中可选用的指示剂是酚酞,滴定终点的现象是当最后一滴NaOH溶液滴入时,待测液由无色变为粉红色,且半分钟内颜色不恢复.
②用0.10mol•L-1的NaOH标准溶液滴定进行滴定,实验数据如表所示,
| 实验编号 | 待测CH3COOH溶液的体积/mL | NaOH溶液的体积/mL |
| 1 | 20.00 | 24.01 |
| 2 | 20.00 | 23.99 |
| 3 | 20.00 | 22.10 |
③若读酸式滴定管读数时,滴定前仰视读数,滴定正确读数,则所测结果偏大;
(4)在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如下图所示,回答下列问题:
①a,b,c,d四点所对应的溶液中,水的电离程度由小到大的顺序为a<d<c<b(用“<”连接)
②c点的 c(NH4+ )=0.5mol•L-1
③请结合图2中信息及题目中数据,用含有n的式子列出Kb(NH3•H2O)的表达式(n-1)×10-7.
14.0.1molAl2(SO4)3与2mol/LNaOH溶液350ml混合,所得沉淀的质量为( )
| A. | 7.8g | B. | 15.6g | C. | 3.9g | D. | 78g |
1.化学与生活、社会发展息息相关,下列有关说法不正确的是( )
| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| B. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| C. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| D. | 向豆浆中加入盐卤(主要成分为MgCl2)可制作豆腐,利用了胶体聚沉的性质 |