题目内容
3.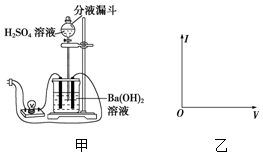 使用中学常用的实验器材,设计一个实验观察Ba(OH)2与H2SO4在溶液中的反应导电性的变化,并回答问题:
使用中学常用的实验器材,设计一个实验观察Ba(OH)2与H2SO4在溶液中的反应导电性的变化,并回答问题:①实验所需器材:铁架台、烧杯、玻璃电极一对(碳棒)、导线、电源、灯泡、分液漏斗.
②连接好装置:实验装置如图甲所示.
③开始实验.
(1)反应前可以看到灯泡明亮,说明溶液中存在大量Ba2+、OH-.
(2)反应开始一段时间,可以看到灯泡变暗,说明Ba(OH)2+H2SO4═BaSO4↓+2H2O,溶液中的离子浓度逐渐减小.
(3)当两种物质完全反应时,可以看到灯泡熄灭,说明溶液中离子浓度很小,几乎为0.
(4)继续操作,可以看到灯泡逐渐变亮,说明溶液中离子浓度又逐渐增大.
(5)试在如图乙的坐标系中画出溶液的导电性(以电流I表示)随滴入的稀硫酸的体积(用V表示)变化趋势图.
分析 向H2SO4溶液中滴加Ba(OH)2溶液至反应完全,发生的离子反应方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,随着硫酸的滴入,溶液中离子的浓度逐渐减小、溶质逐渐减少,导电能力减弱,当两种溶液恰好完全反应时,溶液中几乎没有自由移动的离子,所以电流计偏转程度逐渐减小,最后为零,再加入硫酸,得到的是硫酸溶液,导电能力会逐渐增强,说明溶液的导电性与溶液的离子浓度有关,以此解答该题.
解答 解:(1)实验前为氢氧化钡溶液,溶液中存在大量Ba2+、OH-,具有溶液导电,可观察到灯泡明亮,故答案为:灯泡明亮;溶液中存在大量Ba2+、OH-;
(2)反应开始一段时间,氢氧化钡和硫酸发生中和反应,生成水和硫酸钡沉淀,发生Ba(OH)2+H2SO4═BaSO4↓+2H2O,溶液中离子浓度降低,导电能力下降,灯泡变暗,
故答案为:灯泡变暗;Ba(OH)2+H2SO4═BaSO4↓+2H2O,溶液中的离子浓度逐渐减小;
(3)当两种物质完全反应时,溶液中离子浓度很小,几乎为0,则导电能力最低,灯泡变暗,故答案为:灯泡熄灭;溶液中离子浓度很小,几乎为0;
(4)继续滴加硫酸,溶液中离子浓度增大,则灯泡逐渐变亮,故答案为:灯泡逐渐变亮;溶液中离子浓度又逐渐增大;
(5)滴加硫酸之前,氢氧化钡浓度最大,导电性最强,但随着反应的进行,溶液浓度逐渐降低,导电性减弱,硫酸过量时,导电能力又逐渐增强,如图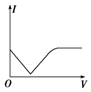 ,
,
故答案为: .
.
点评 本题考查元素化合物性质及离子反应、溶液导电性等知识点,为高频考点,明确导电性与离子浓度关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
14.0.1molAl2(SO4)3与2mol/LNaOH溶液350ml混合,所得沉淀的质量为( )
| A. | 7.8g | B. | 15.6g | C. | 3.9g | D. | 78g |
8.对食物的酸、碱性判断正确的是( )
| A. | 柠檬是酸性食物 | B. | 猪肉、牛肉是碱性食物 | ||
| C. | 大多数的蔬菜和水果是碱性食物 | D. | 大米、面粉是碱性食物 |
15.下列反应中,不属于氧化还原反应的是( )
| A. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | B. | IBr+H2O═HIO+HBr | ||
| C. | 2Na2O2+4HCl═4NaCl+O2+2H2O | D. | NaH+H2O═NaOH+H2 |
12.下列说法不正确的是( )
| A. | 电解熔融氯化钠可制金属钠 | |
| B. | 钠与氧气反应的产物与反应条件无关 | |
| C. | ClO2可用于自来水的消毒 | |
| D. | “氯碱工业”是指电解食盐水制取氯气等产品的工业 |
13.下列物质性质与应用对应关系正确的是( )
| A. | KAl(SO4)2•12H2O能水解生成Al(OH)3胶体,可用作净水剂 | |
| B. | SO2有漂白、杀菌性能,可在食品加工中大量使用 | |
| C. | MnO2有较强的氧化性,可作H2O2分解的氧化剂 | |
| D. | Si是半导体材料,可用于制光导纤维 |
 ,反应中其还原剂是Na2O2.
,反应中其还原剂是Na2O2.