题目内容
7. (一)(1)化学式为C6Hm的烷烃,m值等于14;请写出HCl的电子式
(一)(1)化学式为C6Hm的烷烃,m值等于14;请写出HCl的电子式 .
.(二)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图.
(2)请写出N2和H2反应的热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92.2KJ/mol;
(3)若已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
(4)合成氨反应通常用铁触媒作催化剂.使用铁触媒后E1变化是:E1减小 (填“增大”、“减小、”“不变”).
(5)用NH3催化还原NOX还可以消除氮氧化物的污染.例如
4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H1=akJ•mol-1
N2(g)+O2(g)?2NO(g)△H2=b kJ•mol-1
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3=$\frac{a-3b}{4}$kJ/mol(用含a、b的式子表示)
分析 (1)烷烃的通式为CnH2n+2,化学式为C6Hm的烷烃,m=2×6+2=14;HCl分子是由1个氢原子和1个氯原子通过共用1对电子结合而成的共价化合物其电子式为 ;
;
(2)据焓变等于反应物活化能减去生成物活化能求算焓变,再书写热化学方程式;
(3)根据反应热等于反应物的总键能减去生成物的总键能计算;
(4)使用铁触媒作催化剂,反应的活化能减小;
(5)利用盖斯定律计算.
解答 解:(1)烷烃的通式为CnH2n+2,化学式为C6Hm的烷烃,m=2×6+2=14;HCl分子是由1个氢原子和1个氯原子通过共用1对电子结合而成的共价化合物其电子式为 ,故答案为:14;
,故答案为:14; ;
;
(2)据焓变等于反应物活化能减去生成物活化能求算焓变,N2和H2反应生成2mol NH3过程中的△H=300×2KJ/mol-(3×435+943)KJ/mol=-92.2KJ/mol,所以热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-92.2KJ/mol,故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92.2KJ/mol;
(3)反应热等于反应物的总键能减去生成物的总键能,设N-H的键能为x,则943+3×435-6x=-92,x=390,故答案为:390;
(4)使用铁触媒作催化剂,反应的活化能减小,故答案为:减小;
(5)已知①4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H1=akJ/mol
②N2(g)+O2(g)=2NO(g);△H2=bkJ/mol
利用盖斯定律将$\frac{①-3②}{4}$可得NH3(g)+$\frac{3}{2}$NO(g)=$\frac{5}{4}$N2(g)+$\frac{3}{2}$H2O(g)△H3=$\frac{a-3b}{4}$kJ/mol,所以1mol NH3还原NO至N2,则该反应过程中的反应热△H3=$\frac{a-3b}{4}$kJ/mol,故答案为:$\frac{a-3b}{4}$.
点评 本题考查综合考查化学反应与能量变化知识,注意物质的总能量、键能与反应热的计算关系,把握盖斯定律的计算方法,题目难度中等.

| A. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | B. | IBr+H2O═HIO+HBr | ||
| C. | 2Na2O2+4HCl═4NaCl+O2+2H2O | D. | NaH+H2O═NaOH+H2 |
| A. | 甲基橙呈红色的溶液中:S2O32-、Al3+、C2O42-、SO42- | |
| B. | Kw/c(H+ )=0.1mol•L-1的溶液:K+、Na+、CO32-、NO3- | |
| C. | 0.1mol•L-1 AgNO3溶液:H+、K+、SO42-、I- | |
| D. | 无色溶液中:Cr2O72-、NH4+、Cl-、S2- |
| A. | 电解熔融氯化钠可制金属钠 | |
| B. | 钠与氧气反应的产物与反应条件无关 | |
| C. | ClO2可用于自来水的消毒 | |
| D. | “氯碱工业”是指电解食盐水制取氯气等产品的工业 |
| A. | W的氢化物比X的氢化物稳定 | |
| B. | Y在周期表中的位置为第3周期、IB族 | |
| C. | Z的最高价氧化物对应的水化物的碱性比Y的弱 | |
| D. | X的单质与含W化合物不可能发生置换反应 |
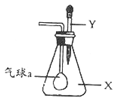 如图,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压胶头滴管的胶头,使液体滴入瓶中,振荡,套在玻璃管一端的小气球慢慢鼓起,则气体X和液体Y不可能是( )
如图,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压胶头滴管的胶头,使液体滴入瓶中,振荡,套在玻璃管一端的小气球慢慢鼓起,则气体X和液体Y不可能是( )| A. | X是氨气,Y是硫酸钠溶液 | B. | X是SO2,Y是Ba(OH)2溶液 | ||
| C. | X是CO2.Y是硫酸溶液 | D. | X是HC1,Y是氯化钠溶液 |
| A. | 甲醇可以使蛋白质变性,常用于食品保鲜 | |
| B. | 氧化铝熔点高,常用子制造耐火材枓 | |
| C. | 氧化钠可用作呼吸面具中的供氧剂 | |
| D. | 常温下,可用铁槽车或铝槽车运输稀硝酸 |