题目内容
14.某溶液中可能含有Na+、I-、K+、Fe 2+、NH4+、Cu2+、SO32-、SO42-且所有 离子物质的量浓度相等.向该无色溶液中加入少量溴水,溶液仍呈无色,则下列判断正确的是( )| A. | 肯定不含I- | B. | 肯定不含NH4+ | C. | 可能含有SO32- | D. | 肯定不含SO42- |
分析 无色溶液中加入溴水仍然无色,说明溴水发生了反应,且产物无色,I-和SO32-均可与溴水反应使溴水褪色,此时反应后溶液无色,说明没有I2,则原溶液中一定有SO32-;由于SO32-的还原性比I-强,故I-是否存在无法判断;因所有离子浓度相等,则根据电荷守恒可判断SO42-肯定没有,以此解答该题.
解答 解:加入溴水仍然无色,说明溴水发生了反应,且产物无色,I-和SO32-均可与溴水反应使溴水褪色,此时反应后溶液无色,说明没有I2,则原溶液中一定有SO32-,故C错误;
由于SO32-的还原性比I-强,故I-是否存在无法判断,故A错误;
因所有离子浓度相等,则根据电荷守恒可判断SO42-肯定没有,故D正确;
根据分析可知,无法判断是否含有铵根离子,故B错误;
故选D.
点评 本题考查常见离子的检验方法,题目难度不大,明确离子反应发生条件为解答关键,注意掌握离子共存的条件,试题培养了学生的分析能力及逻辑推理能力.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
4.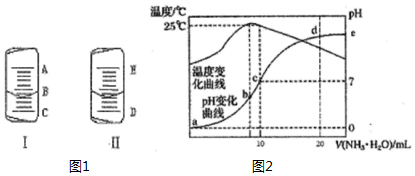 (1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.
(1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.
(2)如图1中的图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)D.
A.是amLB.是(50-a)mL C.-定大于amLD.一定大于(50-a)mL
(3)某校化学兴趣小组的同学用0.1000mol•L-1的NaOH标准溶液对一含有少量杂质(杂质不参与反应)的冰醋酸进行测定,回答下列问题:
①用分析天平准确称取该样品2.500g,全部溶于水配制成250mL的溶液,量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,等待测定,该中和滴定中可选用的指示剂是酚酞,滴定终点的现象是当最后一滴NaOH溶液滴入时,待测液由无色变为粉红色,且半分钟内颜色不恢复.
②用0.10mol•L-1的NaOH标准溶液滴定进行滴定,实验数据如表所示,
计算样品中冰醋酸的质量百分含量为72%.
③若读酸式滴定管读数时,滴定前仰视读数,滴定正确读数,则所测结果偏大;
(4)在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如下图所示,回答下列问题:
①a,b,c,d四点所对应的溶液中,水的电离程度由小到大的顺序为a<d<c<b(用“<”连接)
②c点的 c(NH4+ )=0.5mol•L-1
③请结合图2中信息及题目中数据,用含有n的式子列出Kb(NH3•H2O)的表达式(n-1)×10-7.
 (1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.
(1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.(2)如图1中的图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)D.
A.是amLB.是(50-a)mL C.-定大于amLD.一定大于(50-a)mL
(3)某校化学兴趣小组的同学用0.1000mol•L-1的NaOH标准溶液对一含有少量杂质(杂质不参与反应)的冰醋酸进行测定,回答下列问题:
①用分析天平准确称取该样品2.500g,全部溶于水配制成250mL的溶液,量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,等待测定,该中和滴定中可选用的指示剂是酚酞,滴定终点的现象是当最后一滴NaOH溶液滴入时,待测液由无色变为粉红色,且半分钟内颜色不恢复.
②用0.10mol•L-1的NaOH标准溶液滴定进行滴定,实验数据如表所示,
| 实验编号 | 待测CH3COOH溶液的体积/mL | NaOH溶液的体积/mL |
| 1 | 20.00 | 24.01 |
| 2 | 20.00 | 23.99 |
| 3 | 20.00 | 22.10 |
③若读酸式滴定管读数时,滴定前仰视读数,滴定正确读数,则所测结果偏大;
(4)在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如下图所示,回答下列问题:
①a,b,c,d四点所对应的溶液中,水的电离程度由小到大的顺序为a<d<c<b(用“<”连接)
②c点的 c(NH4+ )=0.5mol•L-1
③请结合图2中信息及题目中数据,用含有n的式子列出Kb(NH3•H2O)的表达式(n-1)×10-7.
2.下列说法中,不正确的是( )
| A. | 管道施工中,不能将铁制自来水管与铜制水龙头连接 | |
| B. | 化学反应过程中,一定有物质的变化,不一定有能量的变化 | |
| C. | 在配制的硫酸亚铁溶液中常加入一定量的铁粉和硫酸 | |
| D. | 已知C(石墨,s)═C(金刚石,s )△H>0,则石墨比金刚石稳定 |
9.胶体区别于其他分散系的本质特征是( )
| A. | 产生丁达尔现象 | B. | 分散质粒子直径 在1-100nm之间 | ||
| C. | 胶体微粒不能透过半透膜 | D. | 加热会聚沉 |
5.关于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,下列说法正确的是( )
| A. | 加入2molNH3反应达平衡时共吸收92.4kJ的热量 | |
| B. | 若转移1.5mol电子,则消耗0.75mol的H2 | |
| C. | 当V正(N2)=3V逆(H2)时,反应达到平衡 | |
| D. | 当反应达到平衡时,增大压强,V逆减小 |
2.常温下,下列各组微粒在指定溶液中一定能大量共存的是( )
| A. | 甲基橙呈红色的溶液中:S2O32-、Al3+、C2O42-、SO42- | |
| B. | Kw/c(H+ )=0.1mol•L-1的溶液:K+、Na+、CO32-、NO3- | |
| C. | 0.1mol•L-1 AgNO3溶液:H+、K+、SO42-、I- | |
| D. | 无色溶液中:Cr2O72-、NH4+、Cl-、S2- |
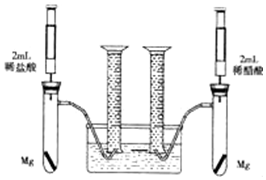 某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)
某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略) .
.