题目内容
8.甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成.电池的总反应式为2CH3OH+3O2+4OH-═2CO32-+6H2O.则下列说法正确的是( )| A. | 电池放电时通入空气的电极为负极 | |
| B. | 由于CO32-水解显碱性,电池放电时,电解质溶液的pH逐渐增大 | |
| C. | 电池放电时负极的电极反应式为CH3OH+8OH--6e-═CO32-+6H2O | |
| D. | 电池放电时每消耗1 mol CH3OH转移8 mol电子 |
分析 根据电池总反应:2CH3OH+3O2+4OH-=2CO32-+6H2O知,负极甲醇失去电子发生氧化反应;正极上氧气得电子发生还原反应,根据电池反应式判断溶液的pH值变化.
解答 解:A.正极氧气上得电子发生还原反应,则氧气参与反应的电极为正极,故A错误;
B.电池总反应:2CH3OH+3O2+4OH-=2CO32-+6H2O,反应消耗氢氧根离子,所以反应后溶液的pH减小,故B错误;
C.放电时,负极上甲醇失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,故C正确;
D.甲醇失电子和氢氧根离子反应生成碳酸根离子和水,则电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,所以电池放电时每消耗1 mol CH3OH转移6 mol电子,故D错误;
故选C.
点评 本题以燃料电池为载体考查了原电池原理,根据电池反应式判断正负极上发生反应的物质及溶液pH值的变化即可解答本题,难度中等,侧重于考查学生的分析能力和应用能力.

练习册系列答案
相关题目
19.短周期主族元素X、Y、Z、W的原子序数依次增大.X是地壳中含量最高的元素,Y+与X2-具有相同的电子层结构,Y与Z位于相邻主族,W与X同主族.下列说法正确的是( )
| A. | W的氢化物比X的氢化物稳定 | |
| B. | Y在周期表中的位置为第3周期、IB族 | |
| C. | Z的最高价氧化物对应的水化物的碱性比Y的弱 | |
| D. | X的单质与含W化合物不可能发生置换反应 |
16.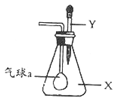 如图,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压胶头滴管的胶头,使液体滴入瓶中,振荡,套在玻璃管一端的小气球慢慢鼓起,则气体X和液体Y不可能是( )
如图,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压胶头滴管的胶头,使液体滴入瓶中,振荡,套在玻璃管一端的小气球慢慢鼓起,则气体X和液体Y不可能是( )
 如图,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压胶头滴管的胶头,使液体滴入瓶中,振荡,套在玻璃管一端的小气球慢慢鼓起,则气体X和液体Y不可能是( )
如图,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压胶头滴管的胶头,使液体滴入瓶中,振荡,套在玻璃管一端的小气球慢慢鼓起,则气体X和液体Y不可能是( )| A. | X是氨气,Y是硫酸钠溶液 | B. | X是SO2,Y是Ba(OH)2溶液 | ||
| C. | X是CO2.Y是硫酸溶液 | D. | X是HC1,Y是氯化钠溶液 |
13.下列物质性质与应用对应关系正确的是( )
| A. | KAl(SO4)2•12H2O能水解生成Al(OH)3胶体,可用作净水剂 | |
| B. | SO2有漂白、杀菌性能,可在食品加工中大量使用 | |
| C. | MnO2有较强的氧化性,可作H2O2分解的氧化剂 | |
| D. | Si是半导体材料,可用于制光导纤维 |
20.下列化学用语正确的是( )
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| B. | 硫酸的电离方程式:H2SO4═2H++SO42- | |
| C. | S2-的结构示意图: | |
| D. | 明矾的化学式:KAl(SO4)2•12H2O |
17.下列有关物质的性质与应用的说法正确的是( )
| A. | 甲醇可以使蛋白质变性,常用于食品保鲜 | |
| B. | 氧化铝熔点高,常用子制造耐火材枓 | |
| C. | 氧化钠可用作呼吸面具中的供氧剂 | |
| D. | 常温下,可用铁槽车或铝槽车运输稀硝酸 |
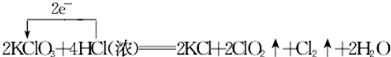 .
. 信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.信息二:氯化铬酰(CrO2Cl2)是铬的一种化合物,常温下该化合物是暗红色液体,熔点为-96.5℃,沸点为117℃,能和丙酮(CH3COCH3)、四氯化碳、CS2等有机溶剂互溶.
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.信息二:氯化铬酰(CrO2Cl2)是铬的一种化合物,常温下该化合物是暗红色液体,熔点为-96.5℃,沸点为117℃,能和丙酮(CH3COCH3)、四氯化碳、CS2等有机溶剂互溶.