题目内容
12.下列关于硫及含硫化合物的叙述正确的是( )| A. | SO2的漂白原理与次氯酸相同 | B. | 硫在足量空气中燃烧生成大量SO3 | ||
| C. | 浓硫酸可以干燥H2、H2S、CO2等气体 | D. | 可用铝槽储运浓硫酸 |
分析 A.根据SO2、次氯酸漂白性的原理分析,二氧化硫的漂白性是利用有色物质和二氧化硫反应生成无色物质,次氯酸的漂白性是利用次氯酸的强氧化性;
B.硫在空气中燃烧生成二氧化硫;
C.硫化氢具有强还原性,可以被浓硫酸氧化吸收;
D.常温下,铝和浓硫酸发生钝化现象而阻止进一步反应.
解答 解:A.二氧化硫的漂白性是利用有色物质和二氧化硫反应生成无色物质,次氯酸的漂白性是利用次氯酸的强氧化性,所以二者漂白原理不同,故A错误;
B.硫在空气中燃烧生成二氧化硫而不是三氧化硫,故B错误;
C.浓硫酸具有强氧化性,硫化氢具有还原性,浓硫酸可以氧化硫化氢生成单质硫,不能用来干燥硫化氢,可以干燥中性气体H2和酸性气体CO2,故C错误;
D.常温下,铝与浓硫酸发生钝化,在表面生成一层致密的氧化膜,阻止反应进行,故D正确;
故选D.
点评 本题考查了元素及其化合物的性质,明确物质的性质是解本题关键,知道二氧化硫、臭氧、活性炭、次氯酸漂白原理,难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
20.甲醛、乙酸和葡萄糖组成的混合物中,碳元素的质量分数是( )
| A. | 27% | B. | 52% | C. | 40% | D. | 41.4% |
7.下列有关叙述正确的是( )
| A. | 因为C和Si是同主族元素,故CO2和SiO2形成的晶体相同 | |
| B. | 在晶体中有阳离子就一定有阴离子 | |
| C. | 由于水分子间可以形成氢键故水分子的稳定性很强 | |
| D. | 在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键 |
17.下列说法不正确的是( )
| A. | 常温下pH=11的氨水中,由水电离产生的c (OH-)=10-11mol/L | |
| B. | pH=3的CH3COOH溶液和pH=11的NaOH溶液等体积混合后的溶液中,c (H+)>c (OH-) | |
| C. | NaHCO3溶液中,存在c (H+)=c (OH-)+c (CO32-) | |
| D. | 0.1mol/L的NH4Cl溶液中:c (Cl-)>c (NH4+)>c (H+)>c (OH-) |
4.下列各种规律描述正确的是( )
| A. | 第ⅠA 族元素单质的熔点随着原子序数递增而升高 | |
| B. | 卤族元素单质的熔点随着原子序数递增而升高 | |
| C. | 第ⅤA族元素的气态氢化物沸点随着原子序数递增而升高 | |
| D. | 第三周期元素形成的简单离子半径随着原子序数递增而增大 |
1.有M、X、Y、Z、W五种原子序数依次增大的短周期主族元素,其中M、Z同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法正确的是( )
| A. | X、M两种元素形成的化合物中只能存在离子键 | |
| B. | 元素Z的某种氧化物具有漂白性,是因为这种氧化物具有强氧化性 | |
| C. | 由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 | |
| D. | 元素W和M的某些单质可作为水处理中的消毒剂 |
2.利用二氧化碳废气生产化工产品是解决室温效应的有效途径之一,对用二氧化碳为主要原料生产的四中产品(如图所示)的相关说法不正确的是 ( )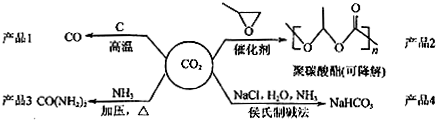

| A. | 反应CO2(g)+C(s)═2CO(g) 的△H>0,△S>0 | |
| B. | 用聚碳酸酯代替聚乙烯等传统塑料,可消除被色污染 | |
| C. | CO(NH2)2与NH4CNO互为同分异构体,两者化学性质相同 | |
| D. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
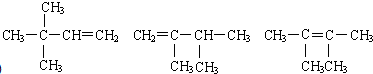 任意一种(写出其中一种即可).
任意一种(写出其中一种即可).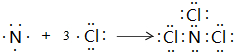 ;
;