题目内容
4.下列各种规律描述正确的是( )| A. | 第ⅠA 族元素单质的熔点随着原子序数递增而升高 | |
| B. | 卤族元素单质的熔点随着原子序数递增而升高 | |
| C. | 第ⅤA族元素的气态氢化物沸点随着原子序数递增而升高 | |
| D. | 第三周期元素形成的简单离子半径随着原子序数递增而增大 |
分析 A.ⅠA 族元素单质的熔点随着原子序数递增而减小;
B.卤素单质的熔点与相对分子质量有关;
C.第ⅤA族元素的气态氢化物中,氨气分子间含氢键,沸点最大;
D.电子层越多,离子半径越大,具有相同原子序数的离子中原子序数大的离子半径最小.
解答 解:A.金属的熔点与金属键有关,由原子半径可知,ⅠA 族元素单质的熔点随着原子序数递增而减小,故A错误;
B.卤素单质的相对分子质量越大,熔点越大,则卤族元素单质的熔点随着原子序数递增而升高,故B正确;
C.第ⅤA族元素的气态氢化物中,氨气分子间含氢键,沸点最大,其它氢化物中沸点随着原子序数递增而升高,故C错误;
D.电子层越多,离子半径越大,具有相同原子序数的离子中原子序数大的离子半径最小,则第三周期中阴离子半径大于阳离子半径,且铝离子半径最小,故D错误;
故选B.
点评 本题考查周期表和周期律的综合应用,为高频考点,把握元素的位置、元素的性质为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识及周期律的应用,题目难度不大.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
14.下列各分子中,所有原子都满足最外层为8电子结构的是( )
| A. | H2O | B. | XeF4 | C. | Cl2 | D. | PCl5 |
15.下列关于原电池的说法正确的是( )
| A. | 在正极上发生氧化反应 | B. | 化学性质较活泼的金属为负极 | ||
| C. | 在外电路,电子流出正极 | D. | 是由电能转化为化学能的装置 |
12.下列关于硫及含硫化合物的叙述正确的是( )
| A. | SO2的漂白原理与次氯酸相同 | B. | 硫在足量空气中燃烧生成大量SO3 | ||
| C. | 浓硫酸可以干燥H2、H2S、CO2等气体 | D. | 可用铝槽储运浓硫酸 |
19.Se、Br两种元素的部分信息如图所示,下列说法正确的是( )


| A. | 原子半径:Br>Se | |
| B. | 还原性:H2Se>HBr | |
| C. | Se在元素周期表中位于第四周期第六族 | |
| D. | 在Se2Br2分子中只含有极性键 |
9.下列各组物质性质的比较中正确的是( )
| A. | CH4、CCl4、C60都是含有极性键的非极性分子 | |
| B. | 非金属氢化物的稳定性顺序:H2O>H2S>H2Se,HCl<H2S<PH3 | |
| C. | 弱电解质水溶液导电能力不一定比强电解质水溶液导电能力弱 | |
| D. | 空间利用率:简单立方堆积<体心立方堆积<六方最密堆积<面心立方最密堆积 |
16.设NA为阿伏加德罗常数的值,下列叙述中指定粒子数目一定小于NA的是( )
| A. | 含1molNa2CO3的溶液中CO32-的微粒数目 | |
| B. | 常温常压下,22.4 L N2的原子数目 | |
| C. | 46gNO2和N2O4的混合气体中的原子数 | |
| D. | 28g铁在反应中作还原剂时,失去电子的数目 |
13.元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语.下列有关化学用语的表示方法中正确的是( )
| A. | 硫原子的原子结构示意图: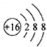 | |
| B. | NH4Cl的电子式: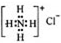 | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 用电子式表示氯化氢分子的形成过程: |
14.下列有关NH4Al(SO4)2溶液的叙述正确的是( )
| A. | 0.1mol/L的该溶液中含有0.2NA个SO42- | |
| B. | 该溶液中Cu2+、H+、NO3-可以大量共存 | |
| C. | 滴入Ba(OH)2溶液恰好使SO42-完全沉淀的离子方程式为:2Ba2++Al3++2SO42-+4OH-═AlO2-+2BaSO4↓+2H2O | |
| D. | 该溶液加热蒸干后得到Al2O3固体 |