题目内容
2.某烃A 0.2mol在氧气中充分燃烧后,生成化合物B、C各1.2mol.若烃A能使溴水褪色,在催化剂作用下,与氢气加成,其加成产物经测定分子中含有4个甲基.烃A可能有的结构简式为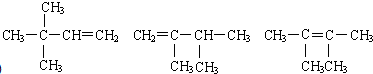 任意一种(写出其中一种即可).
任意一种(写出其中一种即可).
分析 根据原子守恒可知烃A分子式为C6H12,烃A能使溴水褪色,含有1个C=C双键,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,故加成产物的结构简式为 或
或 ,相邻C原子上各去掉1个H原子,还原C=C双键得到A的可能结构简式.
,相邻C原子上各去掉1个H原子,还原C=C双键得到A的可能结构简式.
解答 解:0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol,根据原子守恒,A分子中C原子数目为$\frac{1.2mol}{0.2mol}$=6、H原子数目为$\frac{1.2mol×2}{0.2mol}$=12,故烃A分子式为C6H12,
烃A能使溴水褪色,含有1个C=C双键,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,故加成产物的结构简式为 或
或 ,则A的结构简式为:
,则A的结构简式为: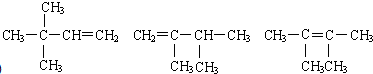 ,
,
故答案为: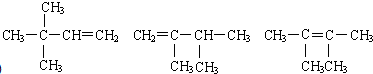 任意一种.
任意一种.
点评 本题考查有机物的推断、烯烃的性质、同分异构体等,难度中等,注意根据加成反应原理利用还原C=C双键法确定A的结构简式.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
12.用等质量铁与稀盐酸反应制备氢气时,欲使生成氢气的化学反应速率增大,下列措施可行的是( )
| A. | 增加铁粒质量 | B. | 换成同浓度的稀硫酸 | ||
| C. | 改成98%的浓硫酸 | D. | 加入纯硝酸 |
13. 在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
(1)反应的离子方程式是Zn+2H+═Zn2++H2↑,该反应为放热反应(填“放热”或“吸热”).
(2)t1=50s,完成下列时间对温度的曲线图(纵轴表示时间,横轴表示温度).
(3)利用所画的曲线图和相关数据,可得出该反应中温度影响反应速率的规律是温度每升高10℃,反应速率加快到原来的2倍.
(4)t1>(填“>”或“<”)t4,原因是G组中可形成Cu-Zn原电池,发生原电池反应,反应速率加快.
t2>t3(填“>”或“<”),原因是F组中锌为粉末状,表面积较大,反应速率较快.
 在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
在锌与盐酸反应的实验中,某同学得到的结果如下表所示:| 锌的质量/g | 锌的形状 | 温度/℃ | 锌完全溶解的时间/s | |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | t1 |
| E | 2 | 颗粒 | 15 | t2 |
| F | 2 | 粉末 | 15 | t3 |
| G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(2)t1=50s,完成下列时间对温度的曲线图(纵轴表示时间,横轴表示温度).
(3)利用所画的曲线图和相关数据,可得出该反应中温度影响反应速率的规律是温度每升高10℃,反应速率加快到原来的2倍.
(4)t1>(填“>”或“<”)t4,原因是G组中可形成Cu-Zn原电池,发生原电池反应,反应速率加快.
t2>t3(填“>”或“<”),原因是F组中锌为粉末状,表面积较大,反应速率较快.
17.关于萃取实验的叙述错误的是( )?
| A. | 为保证分液漏斗内的液体顺利流出,需将上面的塞子拿下 | |
| B. | 进行分液时,分液漏斗中的下层液体从下端流出,上层则从上口倒出 | |
| C. | 萃取、分液前需对分液漏斗进行检漏 | |
| D. | 选用酒精萃取碘水中的碘单质 |
7.下列有机物分子中,可形成顺反异构的是( )
| A. |  | B. |  | C. |  | D. |  |
14.下列各分子中,所有原子都满足最外层为8电子结构的是( )
| A. | H2O | B. | XeF4 | C. | Cl2 | D. | PCl5 |
11. 硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:下列叙述正确的是( )
硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:下列叙述正确的是( )
 硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:下列叙述正确的是( )
硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:下列叙述正确的是( )| A. | Xm-的化学式为B4O8H42- | |
| B. | 硼原子轨道的杂化类型有sp2、sp3 | |
| C. | 配位键存在于4、6原子之间 | |
| D. | 硼砂晶体中有离子键、配位键两种化学键 |
12.下列关于硫及含硫化合物的叙述正确的是( )
| A. | SO2的漂白原理与次氯酸相同 | B. | 硫在足量空气中燃烧生成大量SO3 | ||
| C. | 浓硫酸可以干燥H2、H2S、CO2等气体 | D. | 可用铝槽储运浓硫酸 |
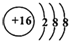 ,该化合物的电子式为
,该化合物的电子式为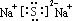 .
.