题目内容
3.现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族.C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子.请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1)A~F六种元素,最高价氧化物的水化物显碱性的元素在周期表中的位置是第三周期第IA族;
(2)A、C、D三种元素组成的一种常见化合物是重要的工业产品,该化合物含有的化学键为离子键、共价键;
(3)B与F两种元素形成的一种化合物分子,各原子均达8e-稳定结构,用电子式表示该化合物的形成过程
 ;
;(4)E的最高价氧化物的水化物可作为铅蓄电池的电解质溶液,写出该电池放电时的正极方程式:正极PbO2+2e-+4H++SO42-=PbSO4+2H2O.
(5)比较E、F的非金属性强弱:E小于F(填大于或小于).写出可以验证该结论的一个化学方程式:
Cl2+H2S=S+2HCl或Cl2+Na2S=S+2NaCl.
分析 A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,C与E同主族,可知C处于第二周期、E处于第三周期,则D、E、F处于第三周期,A、D同主族,二者族序数小于C的,A与C形成的两种化合物在常温下均为液态,则A为H元素,C为O元素,E为S元素,D为Na,A、B的最外层电子数之和与C的最外层电子数相等,则B的最外层电子数为5,结合原子序数可推知B为N元素,H元素能与N元素、O元素形成电子数相等的分子,A能分别与E、F形成电子总数相等的气体分子,则分子含有电子数为18,F的原子序数最大,则F为Cl元素.
解答 解:A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,C与E同主族,可知C处于第二周期、E处于第三周期,则D、E、F处于第三周期,A、D同主族,二者族序数小于C的,A与C形成的两种化合物在常温下均为液态,则A为H元素,C为O元素,E为S元素,D为Na,A、B的最外层电子数之和与C的最外层电子数相等,则B的最外层电子数为5,结合原子序数可推知B为N元素,H元素能与N元素、O元素形成电子数相等的分子,A能分别与E、F形成电子总数相等的气体分子,则分子含有电子数为18,F的原子序数最大,则F为Cl元素.
(1)A~F六种元素,最高价氧化物的水化物显碱性是Na,在周期表中的位置是:第三周期第IA族,
故答案为:第三周期第IA族;
(2)A、C、D三种元素组成的一种常见化合物为NaOH,含有离子键、共价键,
故答案为:离子键、共价键;
(3)B与F两种元素形成的一种化合物分子,各原子均达8e-稳定结构,该分子为NCl3,用电子式表示该化合物的形成过程 ,
,
故答案为: ;
;
(4)E的最高价氧化物的水化物为硫酸,可作为铅蓄电池的电解质溶液,正极发生还原反应,该电池放电时的正极方程式:PbO2+2e-+4H++SO42-=PbSO4+2H2O,
故答案为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;
(5)同周期自左而右非金属性减弱,故非金属性S小于Cl的,可以验证该结论的一个化学方程式:Cl2+H2S=S+2HCl或Cl2+Na2S=S+2NaCl,
故答案为:小于;Cl2+H2S=S+2HCl或Cl2+Na2S=S+2NaCl.
点评 本题考查结构位置性质关系应用,推断元素是解题关键,注意对基础知识的掌握,掌握金属性、非金属性强弱比较实验事实.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案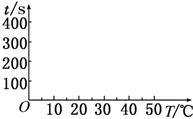 在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
在锌与盐酸反应的实验中,某同学得到的结果如下表所示:| 锌的质量/g | 锌的形状 | 温度/℃ | 锌完全溶解的时间/s | |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | t1 |
| E | 2 | 颗粒 | 15 | t2 |
| F | 2 | 粉末 | 15 | t3 |
| G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(2)t1=50s,完成下列时间对温度的曲线图(纵轴表示时间,横轴表示温度).
(3)利用所画的曲线图和相关数据,可得出该反应中温度影响反应速率的规律是温度每升高10℃,反应速率加快到原来的2倍.
(4)t1>(填“>”或“<”)t4,原因是G组中可形成Cu-Zn原电池,发生原电池反应,反应速率加快.
t2>t3(填“>”或“<”),原因是F组中锌为粉末状,表面积较大,反应速率较快.
| A. | H2O | B. | XeF4 | C. | Cl2 | D. | PCl5 |
 硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:下列叙述正确的是( )
硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:下列叙述正确的是( )| A. | Xm-的化学式为B4O8H42- | |
| B. | 硼原子轨道的杂化类型有sp2、sp3 | |
| C. | 配位键存在于4、6原子之间 | |
| D. | 硼砂晶体中有离子键、配位键两种化学键 |
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)5⑥Fe(SCN)3 ⑦H3O+
⑧[Ag(NH3)2]OH ⑨[B(OH)4]-.
| A. | ①②④⑦⑧ | B. | ③④⑤⑥⑦⑨ | C. | ①④⑤⑥⑦⑧⑨ | D. | 全部 |
| A. | 在正极上发生氧化反应 | B. | 化学性质较活泼的金属为负极 | ||
| C. | 在外电路,电子流出正极 | D. | 是由电能转化为化学能的装置 |
| A. | SO2的漂白原理与次氯酸相同 | B. | 硫在足量空气中燃烧生成大量SO3 | ||
| C. | 浓硫酸可以干燥H2、H2S、CO2等气体 | D. | 可用铝槽储运浓硫酸 |
| A. | 硫原子的原子结构示意图: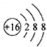 | |
| B. | NH4Cl的电子式: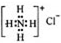 | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 用电子式表示氯化氢分子的形成过程: |