题目内容
17.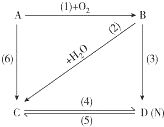 图中A是一种金属单质,B是淡黄色固体,D的焰色反应呈黄色;试指出A、B、C、D是何种物质,并写出有关的化学方程式:
图中A是一种金属单质,B是淡黄色固体,D的焰色反应呈黄色;试指出A、B、C、D是何种物质,并写出有关的化学方程式:(1)ANa;BNa2O2;CNaOH;DNa2CO3.
(2)2Na2O2+2H2O=4NaOH+O2
(3)2Na2O2+2CO2=2Na2CO3+O2;
(4)2NaOH+CO2=Na2CO3+H2O
(5)Na2CO3+Ca(OH)2=CaCO3+2NaOH
(6)2Na+2H2O=2NaOH+H2↑.
分析 根据各物质转化关系,A是一种金属单质,B是淡黄色固体,D的焰色反应呈黄色,则A为,B为,C为NaOH,C与D相互能转化,则D为Na2CO3,据此答题;
解答 解:根据各物质转化关系,A是一种金属单质,B是淡黄色固体,D的焰色反应呈黄色,则A为,B为,C为NaOH,C与D相互能转化,则D为Na2CO3,
(1)根据上面的分析可知A为,B为,C为NaOH,D为Na2CO3,
故答案为:Na、Na2O2、NaOH、Na2CO3;
(2)的化学方程式为2Na2O2+2H2O=4NaOH+O2,
故答案为:2Na2O2+2H2O=4NaOH+O2;
(3)的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(4)的化学方程式为2NaOH+CO2=Na2CO3+H2O,
故答案为:2NaOH+CO2=Na2CO3+H2O;
(5)的化学方程式为Na2CO3+Ca(OH)2=CaCO3+2NaOH,
故答案为:Na2CO3+Ca(OH)2=CaCO3+2NaOH;
(6)的化学方程式为2Na+2H2O=2NaOH+H2↑,
故答案为:2Na+2H2O=2NaOH+H2↑.
点评 本题考查无机物的推断,为高频考点,侧重于钠及其化合物之间的转化,明确物质的性质是解本题关键,以A的颜色及状态结合物质之间的反应来分析解答,题目难度不大.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
7.下列反应中,HCl作为氧化剂的是( )
| A. | HCl+AgNO3═HNO3+AgCl↓ | B. | Mg+2HCl═MgCl2+H2↑ | ||
| C. | MnO2+4HCl═MnCl2+Cl2↑+2H2O | D. | Au+HNO3+4HCl═HAuCl4+NO↑+2H2O |
8.某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、Cl-、OH-、CO32-、NO3-.向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
2.下列说法正确的是( )
| A. | 1 mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热 | |
| B. | 强酸和强碱的稀溶液发生中和反应一定是放热反应,弱酸和弱碱反应一定也是放热反应 | |
| C. | CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,故反应一定是吸热反应 | |
| D. | 酸和碱发生中和反应生成1 mol 水,这时的反应热叫中和热 |
7.设NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A. | 常温常压下,32gO2和O3的混合气体所含原子数为2NA | |
| B. | 将7.1g氯气通入足量水中发生反应,所转移的电子数为0.1NA | |
| C. | 标准状况下,11.2LSO2中含有的分子数为0.5NA | |
| D. | 23g钠与足量氧气充分反应,转移的电子数一定是NA |
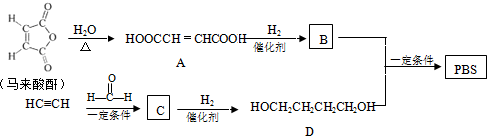
 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$
 →CH≡CH的化学方程式(注明条件)
→CH≡CH的化学方程式(注明条件) 和
和 合成CH3CH2CH2CH2OH的反应流程图(有机物用结构简式表示,必须注明反应条件).
合成CH3CH2CH2CH2OH的反应流程图(有机物用结构简式表示,必须注明反应条件).