题目内容
13.(1)某溶液中可能含有H+,Na+,Ba2+,Mg2+,Fe3+,Al3+,SO42-,CO32-离子,当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图1所示溶液中一定存在的阳离子为H+、Fe3+、Al3+,其物质的量之比1:1:1可能存在的阳离子如何用实验确定焰色反应.
(2)取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图2所示
①曲线A、B的转折点为什么在一条垂直线上A、B点生成二氧化碳体积最大,A、B点均为NaCl溶液,而n(NaCl)=n(NaOH)=n(HCl),即耗的盐酸相同
②曲线B的溶质为NaHCO3、Na2CO3
③A溶液最多还能吸收CO2体积(标况)为134.4mL
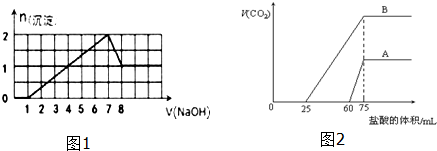
分析 (1)加入0-1体积NaOH溶液体时,没有沉淀生成,而加入1-7体积氢氧化钠溶液生成沉淀,说明溶液中一定含有H+,则一定没有CO32-,根据电荷守恒可知,溶液中一定含有SO42-,则一定不含有Ba2+,加入7-8体积氢氧化钠时沉淀部分溶解,则溶液中一定含有Al3+,从开始生成沉淀到沉淀最大为2mol,消耗氢氧化钠溶液6体积,而氢氧化铝沉淀为1mol,溶解氢氧化铝消耗1体积氢氧化钠溶液,则生成1mol氢氧化铝消耗3体积氢氧化钠溶液,故生成另外1mol沉淀消耗氢氧化钠溶液3体积,则一定含有Fe3+,一定没有Mg2+,溶液中Na+不能确定,可以通过焰色反应进行检验,结合消耗氢氧化钠体积可知溶液中H+为1mol;
(2)①A、B生成二氧化碳体积最大,此时溶液中溶质为NaCl,而n(NaCl)=n(NaOH)=n(HCl),即耗的盐酸相同;
②设反应得到溶液中只有碳酸钠,滴加盐酸发生反应:CO32-+H+=HCO3-,HCO3-+H+=CO2↑+H2O,前后两阶段消耗盐酸的体积相等,而B中实际前、后两阶段消耗盐酸体积分别为250mL、50mL,前阶段消耗盐酸体积小于后阶段,故溶质是NaHCO3、Na2CO3;
③由②中分析可知,A中溶液中溶质为NaOH和Na2CO3,还能吸收二氧化碳最多时,得到NaHCO3,由方程式可知,吸收二氧化碳的最大物质的量等于60mL盐酸中HCl的物质的量.
解答 解:(1)加入0-1体积NaOH溶液体时,没有沉淀生成,而加入1-7体积氢氧化钠溶液生成沉淀,说明溶液中一定含有H+,则一定没有CO32-,根据电荷守恒可知,溶液中一定含有SO42-,则一定不含有Ba2+,加入7-8体积氢氧化钠时沉淀部分溶解,则溶液中一定含有Al3+,从开始生成沉淀到沉淀最大为2mol,消耗氢氧化钠溶液6体积,而氢氧化铝沉淀为1mol,溶解氢氧化铝消耗1体积氢氧化钠溶液,则生成1mol氢氧化铝消耗3体积氢氧化钠溶液,故生成另外1mol沉淀消耗氢氧化钠溶液3体积,则一定含有Fe3+,一定没有Mg2+,溶液中Na+不能确定,中和氢离子消耗NaOH溶液1体积,则溶液中H+为1mol×3×$\frac{1}{3}$=1mol,
由上述分析可知,溶液中一定存在的阳离子为H+、Fe3+、Al3+,其物质的量之比1mol:1mol:1mol=1:1:1,可能存在Na+阳离子,可以通过焰色反应进行检验,
故答案为:H+、Fe3+、Al3+;1:1:1;焰色反应;
(2)①A、B点生成二氧化碳体积最大,A、B点均为NaCl溶液,而n(NaCl)=n(NaOH)=n(HCl),即耗的盐酸相同,则曲线A、B的转折点在一条垂直线上,
故答案为:A、B点生成二氧化碳体积最大,A、B点均为NaCl溶液,而n(NaCl)=n(NaOH)=n(HCl),即耗的盐酸相同;
②设反应得到溶液中只有碳酸钠,滴加盐酸发生反应:CO32-+H+=HCO3-,HCO3-+H+=CO2↑+H2O,前后两阶段消耗盐酸的体积相等,而B中实际前、后两阶段消耗盐酸体积分别为250mL、50mL,前阶段消耗盐酸体积小于后阶段,故溶质是NaHCO3、Na2CO3,
故答案为:NaHCO3、Na2CO3;
③由②中分析可知,A中溶液中溶质为NaOH和Na2CO3,还能吸收二氧化碳最多时,得到NaHCO3,发生反应:NaOH+CO2=NaHCO3、Na2CO3+H2O+CO2=NaHCO3,加入前60mL盐酸,发生反应:NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaHCO3+NaCl,由方程式可知,吸收二氧化碳的最大物质的量等于60mL盐酸中HCl的物质的量,故还可以吸收二氧化碳的物质的量为0.06L×0.1mol/L=0.006mol,故可以吸收二氧化碳的最大体积为0.006mol×22.4L/mol=0.1344L,即为134.4mL,
故答案为:134.4mL.
点评 本题考查离子推断、混合物的有关计算,侧重考查学生分析计算能力,(1)中关键是明确离子反应,(2)中根据前后两阶段消耗盐酸体积判断CO2与NaOH反应产物是关键,③中计算为易错点,学生容易先计算氢氧化钠、碳酸钠的物质的量,再计算二氧化碳体积,注意充分利用方程式解答,难度中等.

| A. | 碘是人体必需的微量元素,所以要多吃富含高碘酸的食物 | |
| B. | 空气中直径小于或等于2.5?m的颗粒物称为PM2.5 | |
| C. | pH<7的雨水称为酸雨,对环境造成很大的危害 | |
| D. | 甲醛的水溶液可以作为鱿鱼等海鲜的防腐剂 |
| A. | 标准状况下,11.2 L的甲醇所含的氢原子数大于2NA | |
| B. | 常温下,1mol•L-1的Na2CO3溶液中CO32-的个数必定小于NA | |
| C. | 1mol Cu与含2mol H2SO4,的浓硫酸充分反应,生成的S02的分子个数为NA | |
| D. | 1mol苯分子中含有3NA个碳碳双键 |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | 1 mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热 | |
| B. | 强酸和强碱的稀溶液发生中和反应一定是放热反应,弱酸和弱碱反应一定也是放热反应 | |
| C. | CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,故反应一定是吸热反应 | |
| D. | 酸和碱发生中和反应生成1 mol 水,这时的反应热叫中和热 |
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | 硝基苯的结构简式: | |
| C. | (CH3 CH2)2 CHCH2CH3 的名称:2-乙基丁烷 | |
| D. | 甲基的电子式为: |


 .
.