题目内容
1.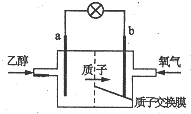 新型乙醇燃料电池比甲醇燃料电池的效率高出32倍,且更安全.其结构如图所示,它用碘酸类质子溶剂,在200℃左右时供电,已知电池总反应式为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是( )
新型乙醇燃料电池比甲醇燃料电池的效率高出32倍,且更安全.其结构如图所示,它用碘酸类质子溶剂,在200℃左右时供电,已知电池总反应式为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是( )| A. | 电池工作时电流由b极沿导线经灯泡到a极 | |
| B. | a极为电池的负极,该电极发生氧化反应 | |
| C. | 电池正极的电极反应式为O2+2H2O+4e-=4OH- | |
| D. | 电池工作时,23g乙醇被氧化转移电子式为6mol |
分析 由质子的定向移动方向可知a为负极,b为正极,负极发生氧化反应,乙醇被氧化生成CO2和H+,电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,正极氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,结合电极反应解答该题.
解答 解:A.电池工作时,电流由正极经外电路流向负极,在该电池中由b极流向a极,故A正确;
B.a极为电池的负极,负极上乙醇失电子,发生氧化反应,故B正确;
C.酸性条件下,正极氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,故C错误;
D.乙醇被氧化生成CO2和H+,电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,则23g乙醇即0.5mol被氧化转移电子式为6mol,故D正确;
故选C.
点评 本题考查原电池知识,题目难度中等,本题注意把握根据电池总反应书写电极方程式的方法,侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
11. 电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1 的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1 的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
 电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1 的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1 的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线①代表滴定HCl溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1mol•L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水的电离程度:C<B<A | |
| D. | D点溶液中:c(Cl-)=2c(OH-)-2c(H+) |
9.下列关于化学平衡常数的说法中错误的是( )
| A. | 某特定反应的平衡常数只与温度有关 | |
| B. | 催化剂不能改变平衡常数的大小 | |
| C. | 平衡常数发生改变,化学平衡必发生改变 | |
| D. | 化学平衡移动时,平衡常数必改变 |
13.下列有关说法正确的是( )
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | pH=3的醋酸溶液中:c(H+)=c(CH3COO-)=3.0mol•L-1 | |
| C. | 某溶液中由水电离出的c(OH-)=1×10-amol•L-1,若a>7时,则该溶液的pH可能为a | |
| D. | 常温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+ )>c(H+)>c(OH-) |
10.已知电离常数:K(NH3•H2O)=1.8×10-5;K1(H2C204)=5.9×10-2,K2(H2C2O4)=6.4×10-5下列说法正确的是( )
| A. | (NH4)2C2O4溶液中,c(NH4+)=2c(C2O42-) | |
| B. | 等物质的量浓度的氨水和H2C204溶液等体积混合,所得溶液呈碱性 | |
| C. | pH=11的氨水和pH=3的H2C204溶液等体积混合,所得溶液呈酸性 | |
| D. | 用H2C204溶液中和氨水至中性时,溶液中c(NH4+)=2c(C2O42-)+c(HC2O4-) |
14.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,c是否一定等于0.2否(选填“是”或“否”).
(2)单从乙组实验结果分析,HA是弱酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(3)丙组实验所得混合溶液中下列算式的精确结果:c(OH-)-c(HA)=10-9mol/L.
| 实验编号 | HA物质的量浓度/(mol•L-1) | NaOH物质的量浓度/(mol•L-1) | 混合溶液的pH |
| 甲 | c | 0.2 | pH=7 |
| 乙 | 0.2 | 0.1 | pH>7 |
| 丙 | 0.1 | 0.1 | pH=9 |
(2)单从乙组实验结果分析,HA是弱酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(3)丙组实验所得混合溶液中下列算式的精确结果:c(OH-)-c(HA)=10-9mol/L.
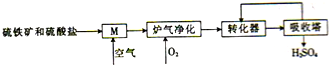 煤是重要的化工原料,煤的脱硫可减少环境的污染,利用煤矸石中的硫铁矿(主要成分为FeS2)和烟道脱硫得到的硫酸盐生产硫酸的工艺流程如图所示.
煤是重要的化工原料,煤的脱硫可减少环境的污染,利用煤矸石中的硫铁矿(主要成分为FeS2)和烟道脱硫得到的硫酸盐生产硫酸的工艺流程如图所示.