题目内容
11. 电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1 的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1 的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线①代表滴定HCl溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1mol•L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水的电离程度:C<B<A | |
| D. | D点溶液中:c(Cl-)=2c(OH-)-2c(H+) |
分析 溶液导电能力与离子浓度成正比,CH3COOH是弱电解质,溶液中离子浓度较小,加入NaOH后,溶液中离子浓度增大,溶液导电性增强;HCl是强电解质,随着NaOH溶液加入,溶液体积增大,导致溶液中离子浓度减小,溶液导电能力减弱,当完全反应式离子浓度最小,继续加入NaOH溶液,离子浓度增大,溶液导电能力增强,根据图知,曲线②代表0.1 mol/L NaOH溶液滴定HC1溶液的滴定曲线,曲线①代表0.1 mol/LNaOH溶液滴定CH3COOH溶液的滴定曲线,据此分析.
解答 解:A.由分析可知,曲线①代表滴定CH3COOH溶液的曲线,故A错误;
B.A点溶液中c(Na+)=0.05mol/L,电解质溶液中都存在电荷守恒,根据电荷守恒得c(CH3COO-)+c(OH-)-c(H+)=c(Na+)=0.05mol/L,故B错误;
C.酸或碱抑制水电离,含有弱离子的盐促进水电离,C点溶质为NaCl,A点溶质为醋酸钠,促进水电离,B点为等物质的量浓度的醋酸钠和NaOH,NaOH会抑制水的电离,所以在相同温度下,水电离的c(H+):B<C<A,故C错误;
D.D点溶液中,c(Na+)=1.5c(Cl-),溶液中电荷守恒为c(Cl-)+c(OH-)=c(Na+)+c(H+),则c(Cl-)=2c(OH-)-2c(H+),故D正确;
故选D.
点评 本题以电导率为载体考查离子浓度大小比较、盐类水解等知识点,题目难度中等,明确混合溶液中溶质及其性质、溶液导电性强弱影响因素是解本题关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的一种药物,已知其结构简式是

则下列关于MMF的说法中,不正确的是( )
①MMF所有原子一定处在同一平面;
②可以跟溴水加成;
③可以被KMnO4酸性溶液氧化;
④可以跟NaHCO3溶液反应;
⑤MMF的分子式为C24H31O7N;
⑥可以发生消去反应;
⑦可以发生加聚反应;
⑧可以发生水解反应;
⑨可以发生取代反应.

则下列关于MMF的说法中,不正确的是( )
①MMF所有原子一定处在同一平面;
②可以跟溴水加成;
③可以被KMnO4酸性溶液氧化;
④可以跟NaHCO3溶液反应;
⑤MMF的分子式为C24H31O7N;
⑥可以发生消去反应;
⑦可以发生加聚反应;
⑧可以发生水解反应;
⑨可以发生取代反应.
| A. | ①③⑦⑧ | B. | ③④⑥⑦ | C. | ①④⑤⑥ | D. | ②④⑤⑧ |
19.下列反应中,反应后固体物质质量增加的是( )
| A. | 氢气通过灼热的Cu0粉末 | B. | 二氧化碳通过Na202粉末 | ||
| C. | 铝粉与Fe203粉末发生铝热反应 | D. | 将锌粉投入CuSO4溶液 |
6.下列各组离子能大量共存的是( )
| A. | K+、Fe3+、Cl-、SCN- | B. | NH4+、H+、NO3-、SO42- | ||
| C. | Ba2+、Na+、HCO3-、SO42- | D. | Fe2+、K+、MnO4-、OH- |
16.有A.B.C.D.E五种短周期主族元素,原子序数依次增大,其中A是宇宙中含量最高的元素,其原子核中无中子,B,D同主族,且B、D最外层电子数之和与A、C的质子数之和相等.C是同周期中原子半径最大的主族元素,下列说法不正确的是( )
| A. | E的单质不具有漂白能力 | |
| B. | A2D与DB2可发生氧化还原反应,氧化产物与还原产物的质量比为2:1 | |
| C. | A2D的还原性弱于AE的还原性 | |
| D. | B与C形成的两种离子化合物中,阴、阳离子个数比相等且所含化学键类型不完全相同 |
20.能在水溶液中大量共存的一组离子是( )
| A. | H+、I-、NO3-、SiO32- | B. | Ag+、Fe3+、Cl-、SO42- | ||
| C. | K+、Cu2+、SO42-、NO3- | D. | NH4+、OH-、Cl-、HCO3- |
1.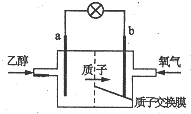 新型乙醇燃料电池比甲醇燃料电池的效率高出32倍,且更安全.其结构如图所示,它用碘酸类质子溶剂,在200℃左右时供电,已知电池总反应式为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是( )
新型乙醇燃料电池比甲醇燃料电池的效率高出32倍,且更安全.其结构如图所示,它用碘酸类质子溶剂,在200℃左右时供电,已知电池总反应式为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是( )
 新型乙醇燃料电池比甲醇燃料电池的效率高出32倍,且更安全.其结构如图所示,它用碘酸类质子溶剂,在200℃左右时供电,已知电池总反应式为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是( )
新型乙醇燃料电池比甲醇燃料电池的效率高出32倍,且更安全.其结构如图所示,它用碘酸类质子溶剂,在200℃左右时供电,已知电池总反应式为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是( )| A. | 电池工作时电流由b极沿导线经灯泡到a极 | |
| B. | a极为电池的负极,该电极发生氧化反应 | |
| C. | 电池正极的电极反应式为O2+2H2O+4e-=4OH- | |
| D. | 电池工作时,23g乙醇被氧化转移电子式为6mol |