题目内容
9.下列关于化学平衡常数的说法中错误的是( )| A. | 某特定反应的平衡常数只与温度有关 | |
| B. | 催化剂不能改变平衡常数的大小 | |
| C. | 平衡常数发生改变,化学平衡必发生改变 | |
| D. | 化学平衡移动时,平衡常数必改变 |
分析 A.反应方程式确定,其化学平衡常数只与温度有关;
B.根据催化剂不影响化学平衡分析;
C.化学平衡常数改变,则反应温度改变,平衡一定发生移动;
D.化学平衡移动时,化学平衡常数可能不变.
解答 解:A.某特定反应的平衡常数只与温度有关,与浓度、催化剂等因素无关,故A正确;
B.催化剂不影响化学平衡,则使用催化剂不能改变平衡常数的大小,故B正确;
C.化学平衡常数改变,则反应温度一定改变,平衡一定发生移动,故C正确;
D.化学平衡移动时,只要温度不变,化学平衡常数不变,所以化学平衡移动时化学平衡常数可能不变,故D错误;
故选D.
点评 本题考查了化学平衡常数的含义、影响因素,题目难度中等,明确化学平衡常数只与温度有关是解本题关键,知道催化剂对反应速率有影响,但对平衡移动无影响.

练习册系列答案
相关题目
19.下列反应中,反应后固体物质质量增加的是( )
| A. | 氢气通过灼热的Cu0粉末 | B. | 二氧化碳通过Na202粉末 | ||
| C. | 铝粉与Fe203粉末发生铝热反应 | D. | 将锌粉投入CuSO4溶液 |
20.能在水溶液中大量共存的一组离子是( )
| A. | H+、I-、NO3-、SiO32- | B. | Ag+、Fe3+、Cl-、SO42- | ||
| C. | K+、Cu2+、SO42-、NO3- | D. | NH4+、OH-、Cl-、HCO3- |
4.在烃的分子中去掉2个氢原子形成一个双键是吸热反应,大约需要117kJ/mol~125kJ/mol的热量,但1,3-环己二烯失去2个氢原子变成苯是放热反应,反应热为23.4kJ/mol.以上事实表明( )
| A. | 1,3-环己二烯加氢是吸热反应 | |
| B. | 完全燃烧时1,3-环己二烯比苯放热多 | |
| C. | 苯加氢生成环己烷是吸热反应 | |
| D. | 苯比1,3-环己二烯稳定 |
14.H2和I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-akJ/mol
已知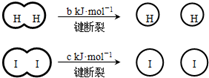 (a、b、c均大于零)
(a、b、c均大于零)
下列说法正确的是( )
已知
 (a、b、c均大于零)
(a、b、c均大于零)下列说法正确的是( )
| A. | H2、I2和HI分子中的化学键都是非极性共价键 | |
| B. | 断开2mol HI分子中的化学键所需能量约为(c+b+a)kJ | |
| C. | 相同条件下,1mol H2(g)和1mol I2(g)总能量小于2molHI(g)的总能量 | |
| D. | 向密闭容器中加入2mol H2(g)和2mol I2(g),充分反应后放出的热量小于2a kJ |
1.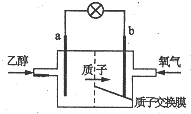 新型乙醇燃料电池比甲醇燃料电池的效率高出32倍,且更安全.其结构如图所示,它用碘酸类质子溶剂,在200℃左右时供电,已知电池总反应式为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是( )
新型乙醇燃料电池比甲醇燃料电池的效率高出32倍,且更安全.其结构如图所示,它用碘酸类质子溶剂,在200℃左右时供电,已知电池总反应式为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是( )
 新型乙醇燃料电池比甲醇燃料电池的效率高出32倍,且更安全.其结构如图所示,它用碘酸类质子溶剂,在200℃左右时供电,已知电池总反应式为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是( )
新型乙醇燃料电池比甲醇燃料电池的效率高出32倍,且更安全.其结构如图所示,它用碘酸类质子溶剂,在200℃左右时供电,已知电池总反应式为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是( )| A. | 电池工作时电流由b极沿导线经灯泡到a极 | |
| B. | a极为电池的负极,该电极发生氧化反应 | |
| C. | 电池正极的电极反应式为O2+2H2O+4e-=4OH- | |
| D. | 电池工作时,23g乙醇被氧化转移电子式为6mol |
18.在实验室进行教材中重点演示实验,括号内的实验仪器或试剂都能用到的是( )
| A. | 蔗糖的水解(试管、蔗糖溶液、新制的Cu(OH)2悬浊液) | |
| B. | 用NaOH标准溶液确定未知浓度的硫酸溶液(石蕊试液、碱式滴定管、锥形瓶) | |
| C. | 证明海带中存在碘元素(漏斗、稀硫酸、氯气、玻璃棒) | |
| D. | 制氢氧化铁胶体(饱和FeCl3溶液、NaOH溶液、胶头滴管) |
2. 想用0.1000mol•L-1NaOH溶液通过中和滴定测定盐酸溶液的物质的量浓度,回答下列问题.
想用0.1000mol•L-1NaOH溶液通过中和滴定测定盐酸溶液的物质的量浓度,回答下列问题.
(1)0.1000mol•L-1NaOH溶液中由水电离出的c(OH)-=1×10-13mol•L-1
(2)滴定时用酸式(填“酸式”或“碱式”)滴定管将待测液移入锥形瓶中.
(3)若滴定时选用的指示剂是酚酞,则终点的想象是滴入最后一滴NaOH标准液,溶液由无色变为粉红色,且半分钟内不褪色
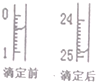
(4)中和滴定有关数据记录如下表,如图表示下表中第1次滴定时50mL滴定管中前后液面的位置
则表中z=24.50mL
(5)根据所给数据,盐酸溶液的物质的量浓度c=0.1020mol•L-1(保留四位有效数字)
(6)下列操作会使测定结果偏高的有ad
a.洗涤碱式滴定管时未用装溶液润洗
b.洗涤时锥形瓶只用蒸馏水洗净后而未润洗
c.读所用标准液体积时,滴定前仰视,滴定后仰视
d.滴定时标准液不小心滴入到锥形瓶外面.
 想用0.1000mol•L-1NaOH溶液通过中和滴定测定盐酸溶液的物质的量浓度,回答下列问题.
想用0.1000mol•L-1NaOH溶液通过中和滴定测定盐酸溶液的物质的量浓度,回答下列问题.(1)0.1000mol•L-1NaOH溶液中由水电离出的c(OH)-=1×10-13mol•L-1
(2)滴定时用酸式(填“酸式”或“碱式”)滴定管将待测液移入锥形瓶中.
(3)若滴定时选用的指示剂是酚酞,则终点的想象是滴入最后一滴NaOH标准液,溶液由无色变为粉红色,且半分钟内不褪色
(4)中和滴定有关数据记录如下表,如图表示下表中第1次滴定时50mL滴定管中前后液面的位置
| 滴定序号 | 待测液体积(mL) | 所消耗NaOH标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 25.00 | x | y | z |
| 2 | 25.00 | 4.00 | 29.60 | 25.60 |
| 3 | 25.00 | 0.60 | 26.00 | 25.40 |
(5)根据所给数据,盐酸溶液的物质的量浓度c=0.1020mol•L-1(保留四位有效数字)
(6)下列操作会使测定结果偏高的有ad
a.洗涤碱式滴定管时未用装溶液润洗
b.洗涤时锥形瓶只用蒸馏水洗净后而未润洗
c.读所用标准液体积时,滴定前仰视,滴定后仰视
d.滴定时标准液不小心滴入到锥形瓶外面.