题目内容
9.KO2能吸收CO2生成K2CO3和O2,故可用作特殊情况下的氧气源,试写出该反应的化学方程式4KO2+2CO2=2K2CO3+3O2.分析 KO2能吸收CO2生成K2CO3和O2,根据反应物和生成物及反应条件书写方程式.
解答 解:KO2能吸收CO2生成K2CO3和O2,根据反应物和生成物及反应条件知,该反应方程式为4KO2+2CO2=2K2CO3+3O2,
故答案为:4KO2+2CO2=2K2CO3+3O2.
点评 本题考查钾的重要化合物,注意超氧化钾中O元素化合价较特殊,注意生成物与反应条件有关,题目难度不大.

练习册系列答案
相关题目
20. 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
(1)该实验应选用酚酞作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管.(选填“酸式滴定管”或“碱式滴定管”)
(2)如图表示25mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为15,滴定管中液面读数为15.40mL.设此时液体体积读数为amL,滴定管中液体的体积V大于(25-a)mL(选填“<”、“>”、“=”).
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为a mol/L.三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液体积明显多于后两次,其原因可能是BC.
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗后,未用标准液润洗
D.滴定NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(可以不化简):c=$\frac{a×\frac{20.32+20.28}{2}}{V}$ mol/L.
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 甲基橙 | 甲基红 | 石蕊 | 酚酞 |
| 变色范围(pH) | 3.1-4.4 | 4.4-6.2 | 5.0-8.0 | 8.2-10.0 |
(2)如图表示25mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为15,滴定管中液面读数为15.40mL.设此时液体体积读数为amL,滴定管中液体的体积V大于(25-a)mL(选填“<”、“>”、“=”).
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为a mol/L.三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 21.02 | 20.32 | 20.28 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗后,未用标准液润洗
D.滴定NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(可以不化简):c=$\frac{a×\frac{20.32+20.28}{2}}{V}$ mol/L.
17.草酸是二元弱酸,测得0.01mol•L-1草酸氢钠溶液显酸性.常温下向10mL 0.01mol•L-1 NaHC2O4溶液中滴加0.01mol•L-1 NaOH溶液,随着NaOH溶液体积的增加,下列说法正确的是( )
| A. | V(NaOH)=0时,c(Na+)>c(H+)>c(HC2O4- )>c(C2O42-)>c(OH-) | |
| B. | V(NaOH)=5 mL时,c(Na+)═c(C2O42-)+c(HC2O4- )+c(H2C2O4) | |
| C. | V(NaOH)=10 mL时,c(Na+)═c(HC2O4-)+c(C2O42-) | |
| D. | V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4- ) |
4. 室温时,向20mL0.1mol•L-1的醋酸溶液中不断滴人0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL0.1mol•L-1的醋酸溶液中不断滴人0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
 室温时,向20mL0.1mol•L-1的醋酸溶液中不断滴人0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL0.1mol•L-1的醋酸溶液中不断滴人0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )| A. | a点时:c( CH3COOH)>c( Na+)>c( CH3COO-)>c( H+)>c( OH -) | |
| B. | b点时:c( Na+)=c( CH3COO-)>c(H+)=c( OH-) | |
| C. | c点时:c(H+)=c(CH3COOH)+c( OH-) | |
| D. | d点时:c(Na+)>c(CH3COO -)>c(OH-)>c(H+) |
1.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
(1)从甲组情况分析,(填“能”或“不能”)不能判断HA是强酸还是弱酸.
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)相等,则乙组混合溶液中存在3个动态平衡.
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+ )>c(A- )>c( OH-)>c( H+)
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=10-4-10-10mol•L-1
(5)用离子方程式解释丁溶液pH=10的原因是A-+H2O?HA+OH-.
| 实验编号 | HA的物质的量 浓度(mol•L-1) | NaOH的物质的量 浓度(mol•L-1) | 混合后 溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)相等,则乙组混合溶液中存在3个动态平衡.
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+ )>c(A- )>c( OH-)>c( H+)
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=10-4-10-10mol•L-1
(5)用离子方程式解释丁溶液pH=10的原因是A-+H2O?HA+OH-.
19.现有部分短周期元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是614C;
(2)实验室检验Y元素的气态氢化物的方法和现象是用湿润的红色石蕊试纸检验,试纸变蓝;
(3)Z元素与氢元素、氧元素形成的化合物HZO有漂白性,其结构式为H-O-Cl;
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填分子式),理由是H2CO3是弱酸,其余均为强酸;
(5)将T元素的氧化物TO2和Z的单质同时通入水中,可发生反应,该反应化学方程式为Cl2+SO2+2H2O=2HCl+H2SO4.
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子占核外电子总数的$\frac{3}{8}$ |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)实验室检验Y元素的气态氢化物的方法和现象是用湿润的红色石蕊试纸检验,试纸变蓝;
(3)Z元素与氢元素、氧元素形成的化合物HZO有漂白性,其结构式为H-O-Cl;
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填分子式),理由是H2CO3是弱酸,其余均为强酸;
(5)将T元素的氧化物TO2和Z的单质同时通入水中,可发生反应,该反应化学方程式为Cl2+SO2+2H2O=2HCl+H2SO4.
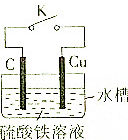 某同学为了探究原电池原理,设计如图所示装置:
某同学为了探究原电池原理,设计如图所示装置: