题目内容
20. 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 甲基橙 | 甲基红 | 石蕊 | 酚酞 |
| 变色范围(pH) | 3.1-4.4 | 4.4-6.2 | 5.0-8.0 | 8.2-10.0 |
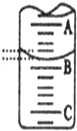
(2)如图表示25mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为15,滴定管中液面读数为15.40mL.设此时液体体积读数为amL,滴定管中液体的体积V大于(25-a)mL(选填“<”、“>”、“=”).
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为a mol/L.三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 21.02 | 20.32 | 20.28 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗后,未用标准液润洗
D.滴定NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(可以不化简):c=$\frac{a×\frac{20.32+20.28}{2}}{V}$ mol/L.
分析 (1)根据醋酸与氢氧化钠反应生成了醋酸钠,醋酸钠属于强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂;精确量取醋酸应该用酸式滴定管;
(2)A与C刻度间相差1ml,说明每两个小格之间是0.1mL,A处的刻度15,据此确定B的刻度,注意滴定管的上面数值小,下面数值大;
(3)根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(4)第一次消耗NaOH溶液体积过大,应舍去,利用第二、三次消耗NaOH溶液的平均体积,再根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析计算浓度.
解答 解:(1)醋酸与氢氧化钠反应生成了醋酸钠,醋酸钠属于强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂,故选酚酞;白醋是酸,移取一定体积的白醋应该用酸式滴定管量取;
故答案为:酚酞;酸式滴定管;
(2)A与C刻度间相差1ml,说明每两个小格之间是0.10mL,A处的刻度为15,A和B之间是四个小格,所以相差0.40mL,则B是15.40mL,由于滴定管25.00mL刻度下方还有液体,若此时液体体积读数为amL,滴定管中液体的体积大于(25-a)mL;
故答案为:15.40;大于;
(3)从上表可以看出,第一次实验中记录消耗NaOH溶液体积明显多于后两次,上面测得的醋酸浓度偏大,
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积,造成V(标准)偏小,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,故A错误;
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡,造成V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,故B正确;
C.盛装标准液的滴定管装液前用蒸馏水润洗后,未用标准液润洗,标准液被稀释,造成V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,故C正确;
D.滴定NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定,造成V(标准)偏小,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,故D错误;
故选BC;
(4)第一次消耗氢氧化钠溶液体积过大,应舍去,利用第二、三次消耗NaOH溶液的平均体积=$\frac{20.32+20.28}{2}$mL,则c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$=
$\frac{amol/L×\frac{20.32+20.28}{2}mL}{VmL}$;
故答案为:$\frac{a×\frac{20.32+20.28}{2}}{V}$;
点评 本题考查酸碱滴定实验,难度中等,会根据实际需要选取指示剂,注意滴定管上的刻度和量筒上刻度的区别,为易错点.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案| A. | 日常生活中常用无水乙醇做消毒剂 | |
| B. | 乙烯和苯都可以发生加成反应,都可以通过石油分馏得到 | |
| C. | 等物质的量的乙烯和乙醇完全燃烧时消耗氧气的质量相等 | |
| D. | 糖类、油脂、蛋白质都可以水解 |
| A. | 1:9 | B. | 9:1 | C. | 10:1 | D. | 1:10 |
 学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:(A)移取25.00mL待测的盐酸溶液,加入1-2滴酚酞试剂
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)BDCEAF,本实验中的标准溶液装在图中的乙中,若某实验中需要用高锰酸钾进行滴定,则选择图中的甲.
(2)上述(B)操作的目的是防止将标准液稀释.
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)偏大.
(4)实验中用左手控制碱式滴定管橡皮管玻璃珠处(填仪器及部位),眼睛注视锥形瓶中溶液的颜色变化,直至滴定终点.判断到达终点的现象是锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色.
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是偏小.
(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是偏大
(7)滴定结果
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
| A. | SiO2>CsCl>CBr4>CF4 | B. | CF4>CCl4>CBr4>Cl4 | ||
| C. | 金刚石>晶体硅>二氧化硅>碳化硅 | D. | NaF>MgF2>AlF3 |
| A. |  三脚架 | B. |  研钵 | C. |  镊子 | D. |  瓷坩埚 |