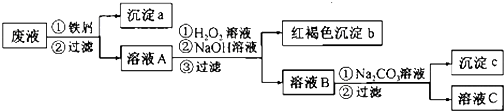
题目内容
11.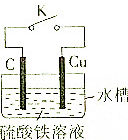 某同学为了探究原电池原理,设计如图所示装置:
某同学为了探究原电池原理,设计如图所示装置:(1)断开K时,写出水槽中物质发生反应的离子方程式Zn+2H+═=Zn2++H2↑;
(2)闭合K时,该装置开始放电,回答下列问题:
①该装置将化学能转化成电能,工作一段时间后,该装置中溶液的颜色由黄色变成浅绿色
②石墨(C)极是正极(填“正极”或“负极”).
③若用镁极替代石墨电极,关闭K并放电时,负极的电极反应式为Mg-2e-=Mg2+.
分析 (1)打开开关K,观察到锌片溶解,其反应实质是锌和酸发生置换反应;
(2)①原电池反应时,化学能转化为电能;铁离子在正极上得电子生成亚铁离子;
②Cu失电子为负极,石墨为正极;
③Mg、Cu构成原电池时,Mg失电子作负极.
解答 解:(1)打开开关K,观察到锌片溶解,表面产生大量气泡,铜片表面无明显现象,说明锌和酸发生置换反应、铜不发生反应,离子方程式为Zn+2H+═=Zn2++H2↑,故答案为:Zn+2H+═=Zn2++H2↑;
(2)①闭合K时,该装置为原电池,开始放电时,化学能转化为电能;铁离子在正极上得电子生成亚铁离子,所以溶液由黄色变为浅绿色;
故答案为:化学;浅绿色;
②Cu失电子为负极,石墨为正极,正极上铁离子得电子;
故答案为:正极;
③若用镁极替代石墨电极,关闭K并放电,Mg、Cu构成原电池时,Mg失电子作负极,负极的电极反应为:Mg-2e-=Mg2+;
故答案为:Mg-2e-=Mg2+.
点评 本题考查原电池知识,侧重于原电池的原理的应用的考查,注意把握电解方程式的书写以及原电池的工作原理,难度不大.

练习册系列答案
 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
1.常温下,将醋酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中( )
| A. | c(CH3COO-)>c(Na+) | B. | c(CH3COO-<c(Na+) | ||
| C. | c(CH3COO-)=c(Na+) | D. | 无法确定c(CH3COO-)与c(Na+)的关系 |
2.下列关于有机化合物的说法正确的是( )
| A. | 日常生活中常用无水乙醇做消毒剂 | |
| B. | 乙烯和苯都可以发生加成反应,都可以通过石油分馏得到 | |
| C. | 等物质的量的乙烯和乙醇完全燃烧时消耗氧气的质量相等 | |
| D. | 糖类、油脂、蛋白质都可以水解 |
11.已知90℃时,Kw=1.0×10-12,在90℃将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所得溶液pH=7,则NaOH溶液与硫酸溶液的体积比为( )
| A. | 1:9 | B. | 9:1 | C. | 10:1 | D. | 1:10 |
8. 学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取25.00mL待测的盐酸溶液,加入1-2滴酚酞试剂
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)BDCEAF,本实验中的标准溶液装在图中的乙中,若某实验中需要用高锰酸钾进行滴定,则选择图中的甲.
(2)上述(B)操作的目的是防止将标准液稀释.
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)偏大.
(4)实验中用左手控制碱式滴定管橡皮管玻璃珠处(填仪器及部位),眼睛注视锥形瓶中溶液的颜色变化,直至滴定终点.判断到达终点的现象是锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色.
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是偏小.
(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是偏大
(7)滴定结果
则该盐酸的浓度为0.08mol/L.
 学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:(A)移取25.00mL待测的盐酸溶液,加入1-2滴酚酞试剂
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)BDCEAF,本实验中的标准溶液装在图中的乙中,若某实验中需要用高锰酸钾进行滴定,则选择图中的甲.
(2)上述(B)操作的目的是防止将标准液稀释.
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)偏大.
(4)实验中用左手控制碱式滴定管橡皮管玻璃珠处(填仪器及部位),眼睛注视锥形瓶中溶液的颜色变化,直至滴定终点.判断到达终点的现象是锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色.
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是偏小.
(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是偏大
(7)滴定结果
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
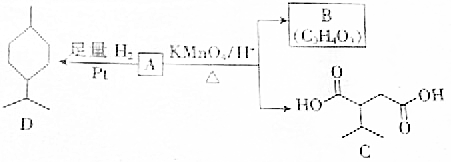
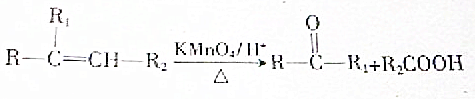
 .A与等物质量的溴单质反应的产物有3种.
.A与等物质量的溴单质反应的产物有3种.