题目内容
13.已知反应A+B?C+D的能量变化如图所示,下列说法正确的是( )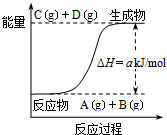
| A. | 该体系的压强不变时标志此反应处于平衡状态 | |
| B. | 若该反应中有电子得失,则可设计成原电池 | |
| C. | 反应物的总键能高于生成物的总键能 | |
| D. | 该反应中的反应物A和B的转化率一定相同 |
分析 A.A+B?C+D反应中ABCD都是气体,反应前后压强始终不变;
B.若该反应中有电子得失为氧化还原反应,反应是吸热反应,不一定能自发进行;
C.反应焓变=反应物的总键能-生成物的总键能;
D.转化率等于消耗量除以起始量,若起始量不同,消耗量相同,转化率不同.
解答 解:A.图象分析可知,反应无能量低于生成物,反应为吸热反应,A+B?C+D反应中ABCD都是气体,反应前后压强始终不变,压强不变不能说明反应达到平衡状态,故A错误;
B.若该反应中有电子得失为氧化还原反应,反应是吸热反应,不一定能自发进行,非自发进行的氧化还原反应不能设计为原电池,故B错误;
C.当反应物的总键能高于生成物的总键能反应的焓变为正值,反应为吸热反应,符合图象变化,故C正确;
D.反应物A和B的转化率和起始量变化量有关,若起始量不同,转化率也不同,故D错误;
故选C.
点评 本题考查了化学反应能量变化分析,图象分析方法和应用,注意反应吸热放热和反应条件关系的判断应用,题目较简单.

练习册系列答案
相关题目
1.同周期的X、Y、Z三种元素,已知其最高价氧化物相应水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中,正确的是( )
| A. | 阴离子的还原性:Z>Y>X | B. | 单质的非金属性:X>Y>Z | ||
| C. | 气态氢化物的稳定性:X<Y<Z | D. | 原子原子半径:X>Y>Z |
8.下列叙述正确的是( )
| A. | 25℃时向水中加入少量固体CH3COONa,平衡逆向移动,c (H+)降低,Kw不变 | |
| B. | 由水电离出的c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存 | |
| C. | 向Na2CO3溶液中加入NaOH溶液后,c(CO32- )减少 | |
| D. | 某温度时的混合溶液中c(H+)=$\sqrt{{K}_{W}}$mol•L-1,说明该溶液呈中性(KW为该温度时水的离子积常数) |
4.下列图示关系不正确的是( )
| A. | 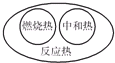 | B. | 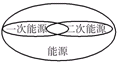 | C. |  | D. | 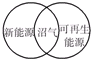 |
1.钢铁发生吸氧腐蚀时,正极上发生的电极反应是( )
| A. | 2H++2e-=H2↑ | B. | Fe=Fe2++2e- | ||
| C. | 2H2O+O2+4e-=4OH- | D. | 4OH-=2H2O+O2↑+4e- |
2.下列实验装置或操作与粒子的大小无直接关系的是( )
| A. |  过滤 | B. |  渗析 | C. |  分液 | D. |  丁达尔效应 |