题目内容
1.下列分子中每个原子的最外层都满足8电子的是( )| A. | F2 | B. | H2O | C. | PCl3 | D. | SO2 |
分析 如果化合物中元素的最外层电子数+化合价的绝对值=8,则该元素满足8电子稳定结构,否则不是,据此对各选项进行判断.
解答 解:A.F2中N原子最外层7个电子,N原子形成1个共价键,每个共价键提供一个电子,所以每个F原子周围电子数为:7+1=8,故A正确;
B.水分子中,氢原子最外层有2个电子,所以氢原子不满足8电子稳定结构,故B错误;
C.PCl3中P元素化合价为+3,P原子最外层电子数为5,所以3+5=8,P原子满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,成键原子不同共用电子对会发生偏移,故C正确;
D.SO2分子中,S原子的最外层含有6个电子,S的化合价为+4,则二氧化硫分子中S的最外层电子数为:6+4=10,故D错误;
故选AC.
点评 本题考查原子核外电子排布,题目难度不大,注意根据“化合物中元素的最外层电子数+化合价的绝对值=8,则该元素满足8电子稳定结构”分析,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
11.下列实验操作中,不正确的是( )
| A. | 配制1.00mol/LNaCl溶液时,将称好的NaCl固体直接放入容量瓶中溶解 | |
| B. | 蒸馏时,冷却水从冷凝管的下口通入,上口流出 | |
| C. | 用分液漏斗分液时,下层液体从下口放出,上层液体从上口倒出 | |
| D. | 用四氯化碳萃取碘水中的碘单质 |
12.下列措施中使得水的电离平衡H2O?H++OH-正方向移动的是( )
| A. | 滴入盐酸 | B. | 滴入氢氧化钠溶液 | ||
| C. | 加热 | D. | 加水 |
16.在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )
| A. | 将CO2溶于水中 | B. | Na2O2溶于水中 | C. | 将SO3溶于水中 | D. | NaHSO4溶于水中 |
6.某酸性工业废水,可能含有Fe3+、Fe2+、Cu2+、Ca2+、Cl-、NO3-、Br-、I-中的一种或几种,为了能回收其中的某些成分,进行了以下实验: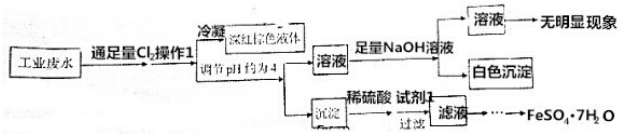
已知pH=4时,Fe3+沉淀完全,而Cu2+、Ca2+未沉淀.
下列说法不正确的是( )

已知pH=4时,Fe3+沉淀完全,而Cu2+、Ca2+未沉淀.
下列说法不正确的是( )
| A. | 该工业废水中肯定存在Cu2+、I- | |
| B. | 若废水中存在NO3-,则肯定存在Fe3+ | |
| C. | 操作1为鼓入热空气,试剂1为Fe | |
| D. | 为了得到FeSO4•7H2O,需要经过蒸发浓缩、冷却结晶,过滤、洗涤、干燥 |
13.硅在自然界中只以化合态形式存在,如铁矿石中的硅主要以脉石(SiO2)的形式存在,炼铁时为了除去脉石,向炼铁高炉中加入石灰石.该过程不可能涉及的化学反应是( )
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | 2FeO+Si$\frac{\underline{\;高温\;}}{\;}$2Fe+SiO2 | ||
| C. | SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑ | D. | CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3 |
14.现有三种可溶性物质A、B、C,其中A、B是盐,C是碱,它们溶于水后电离产生的所有离子如下表所示:
回答下列问题:
(1)C的化学式为Ba(OH)2.
(2)A溶液与B溶液反应可生成气体X,则NA个X分子的质量为44,该反应的离子方程式为2H++CO32-=H2O+CO2↑.
(3)A、B溶液分别与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸.
①B的化学式为NaHSO4,鉴别B溶液中溶质电离m的阴离子的试剂为盐酸、BaCl2溶液.
②D溶于稀硝酸的离子方程式为2H++BaCO3=Ba2++H2O+CO2↑.
③D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下的体积为bL,则E在混合物中的质量分数的表达式为$\frac{a-\frac{197V}{22.4}}{a}$×100%.
| 阳离子 | Na+ | H+ | Ba2+ |
| 阴离子 | OH- | CO32- | SO42- |
(1)C的化学式为Ba(OH)2.
(2)A溶液与B溶液反应可生成气体X,则NA个X分子的质量为44,该反应的离子方程式为2H++CO32-=H2O+CO2↑.
(3)A、B溶液分别与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸.
①B的化学式为NaHSO4,鉴别B溶液中溶质电离m的阴离子的试剂为盐酸、BaCl2溶液.
②D溶于稀硝酸的离子方程式为2H++BaCO3=Ba2++H2O+CO2↑.
③D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下的体积为bL,则E在混合物中的质量分数的表达式为$\frac{a-\frac{197V}{22.4}}{a}$×100%.

 )
) .
.