题目内容
下列说法正确的是( )
| A、Na2O2、Cl2、SO2依次属于电解质、单质、非电解质 |
| B、标准状况下,1 mol Na2O2和22.4 L SO2反应,转移电子数目为NA |
| C、等物质的量Cl2和SO2同时通入品红溶液,褪色更快 |
| D、在Na2O2中阴阳离子所含的电子数目相等 |
考点:钠的重要化合物,氯气的化学性质,二氧化硫的化学性质
专题:元素及其化合物
分析:A、根据概念进行解答,自身电离出离子,能导电的化合物是电解质,自身不能电离出自由移动的离子的化合物属于非电解质,由同种元素组成的物质是单质;
B、发生反应Na2O2+SO2=Na2SO4,反应中过氧化钠起氧化剂作用,氧元素化合价由-1价降低为-2价,据此计算;
C、等物质的量Cl2和SO2同时通入品红溶液,发生反应Cl2+SO2+H22O=2HCl+H2SO4,没有漂白性质;
D、Na2O2中阴离子为O22-、阳离子Na+.
B、发生反应Na2O2+SO2=Na2SO4,反应中过氧化钠起氧化剂作用,氧元素化合价由-1价降低为-2价,据此计算;
C、等物质的量Cl2和SO2同时通入品红溶液,发生反应Cl2+SO2+H22O=2HCl+H2SO4,没有漂白性质;
D、Na2O2中阴离子为O22-、阳离子Na+.
解答:
解:A、Na2O2是离子化合物,属于电解质,Cl2由同种元素组成,属于单质,SO2属于非金属氧化物,自身不能电离出自由移动的离子,属于非电解质,故A正确;
B、发生反应Na2O2+SO2=Na2SO4,反应中过氧化钠起氧化剂作用,氧元素化合价由-1价降低为-2价,1 mol Na2O2和22.4LSO2恰好反应,转移电子数目为1mol×2×[(-1)-(-2)]×NAmol-1=2NA,故B错误;
C、等物质的量Cl2和SO2同时通入品红溶液,发生反应Cl2+SO2+H22O=2HCl+H2SO4,HCl、H2SO4没有漂白性质,故C错误;
D、Na2O2中阴离子为O22-、阳离子Na+,二者含有的电子数分别是18、10,故D错误;
故选A.
B、发生反应Na2O2+SO2=Na2SO4,反应中过氧化钠起氧化剂作用,氧元素化合价由-1价降低为-2价,1 mol Na2O2和22.4LSO2恰好反应,转移电子数目为1mol×2×[(-1)-(-2)]×NAmol-1=2NA,故B错误;
C、等物质的量Cl2和SO2同时通入品红溶液,发生反应Cl2+SO2+H22O=2HCl+H2SO4,HCl、H2SO4没有漂白性质,故C错误;
D、Na2O2中阴离子为O22-、阳离子Na+,二者含有的电子数分别是18、10,故D错误;
故选A.
点评:考查物质分类的基本概念、钠的重要化合物、氧化还原反应、氯气与二氧化硫的性质等,难度不大,重要B选项中过氧化钠全部起氧化剂作用.

练习册系列答案
相关题目
在2L密闭容器中加入或通入一定量A、B、C三种物质,在一定条件下发生反应(如图1),3min后给体系加热,气体C的体积分数Ψ(C)和混合气体的平均相对分子质量M均随温度分别发生了图示变化(如图2、图3).下列有关说法不正确的是( )
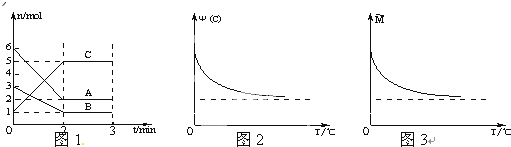

| A、前2min中C的平均反应速率为1mol/L?min |
| B、该反应的化学方程式为:2A+B?2C |
| C、正反应是放热反应 |
| D、A、B一定均为气态 |
下列反应中,属于取代反应的是( )
| A、乙烯与溴反应制1,2-二溴乙烷 |
| B、苯酚与浓溴水反应生成三溴苯酚 |
| C、甲苯使酸性高锰酸钾溶液褪色 |
| D、在一定条件下苯与氢气反应制取环己烷 |
当有机物分子中的一个碳原子所连接的四个原子或原子团均不相同时,此碳原子为“手性碳原子”,具有手性碳原子的物质往往具有旋光性,存在对映异构体,如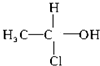 .下列化合物中存在对映异构体的是( )
.下列化合物中存在对映异构体的是( )
 .下列化合物中存在对映异构体的是( )
.下列化合物中存在对映异构体的是( )| A、C2H5CH=CHCH(CH3)-CH=CHC2H5 |
B、 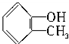 |
| C、甲酸 |
| D、C6H5CH(CH3)OCH3 |
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、16g CH4与18g NH4+所含质子数相等 |
| B、1mol 苯分子中含有碳碳双键数为3N |
| C、将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为约22.4L |
| D、等物质的量的甲基(-CH3)和羟基(-OH)所含电子数相等 |
向CuSO4的溶液中投入一小块金属钠,可观察到的现象是(双选)( )
| A、有较多的铜析出 |
| B、有气体产生 |
| C、有蓝色沉淀产生 |
| D、有白色沉淀产生 |
下列状态的物质,既属于电解质又能导电的是( )
| A、酒精 | B、氯化钾晶体 |
| C、液氯 | D、熔融的氢氧化钠 |
X、Y、Z和W代表原子序数依次增大的四种短周期主族元素,它们满足以下条件:①X、Y、W分别位于不同周期;②在元素周期表中,Z和Y、W均相邻;③Y元素是同周期所有元素中未成对电子最多的元素.下列说法正确的是( )
| A、离子半径:X<Y<Z<W |
| B、Z与W两种元素形成的最简单化合物是平面三角形,为非极性分子 |
| C、由X、Y、Z三种元素形成的化合物,既可以是离子化合物,又可以是共价化合物 |
| D、X2Z的熔点比X2W高,是因为X2Z分子内存在氢键 |