题目内容
下列微粒不具有氧化性的是( )
| A、Cl2 |
| B、Cl- |
| C、H+ |
| D、Fe2+ |
考点:氧化还原反应
专题:
分析:处于最高价的微粒具有氧化性,处于最低价的微粒具有还原性,处于中间价态的微粒既有氧化性又有还原性,以此来解答.
解答:
解:A.Cl元素的化合价为0,为中间价态,有氧化性,故A不选;
B.Cl元素的化合价为-1价,为最低价,只具有还原性,故B选;
C.H元素的化合价为+1价,为最高价,只具有氧化性,故C不选;
D.Fe元素的化合价为+2价,为中间价态,有氧化性,故D不选;
故选B.
B.Cl元素的化合价为-1价,为最低价,只具有还原性,故B选;
C.H元素的化合价为+1价,为最高价,只具有氧化性,故C不选;
D.Fe元素的化合价为+2价,为中间价态,有氧化性,故D不选;
故选B.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价与微粒性质的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
今有下列仪器:铁架台、铁圈、铁夹、三脚架、石棉网、烧杯、漏斗、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、蒸馏烧瓶、坩埚钳、火柴、滤纸,从缺乏必要的仪器和用品的角度考虑,不能进行的分离操作是( )
| A、蒸发 | B、萃取 | C、过滤 | D、蒸馏 |
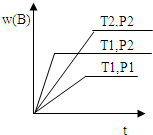 已知某反应aA(g)+bB(g)?cC(g)△H=Q 在密闭容器中进行,在不同温度(T1和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )
已知某反应aA(g)+bB(g)?cC(g)△H=Q 在密闭容器中进行,在不同温度(T1和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )| A、T1<T2,P1<P2,a+b>c,Q>0 |
| B、T1>T2,P1<P2,a+b<c,Q<0 |
| C、T1<T2,P1>P2,a+b<c,Q>0 |
| D、T1<T2,P1>P2,a+b>c,Q<0 |
在2L密闭容器中加入或通入一定量A、B、C三种物质,在一定条件下发生反应(如图1),3min后给体系加热,气体C的体积分数Ψ(C)和混合气体的平均相对分子质量M均随温度分别发生了图示变化(如图2、图3).下列有关说法不正确的是( )
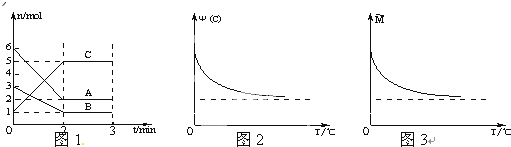

| A、前2min中C的平均反应速率为1mol/L?min |
| B、该反应的化学方程式为:2A+B?2C |
| C、正反应是放热反应 |
| D、A、B一定均为气态 |
已知:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1.现将一定量的稀盐酸、浓硫酸、稀醋酸分别和1L 1mol?L-1的NaOH溶液恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2和△H3的大小关系为( )
| A、△H1=△H2>△H3 |
| B、△H3>△H2>△H1 |
| C、△H2>△H1>△H3 |
| D、△H3>△H1>△H2 |
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,其反应原理是:2NO(g)+2CO(g)═N2(g)+2CO2(g),在298K、101kPa下△H=-113kJ?mol-1,△S=-145J?mol-1?K-1.下列说法中不正确的是( )
| A、该反应中反应物总能量高于生成物的总能量 |
| B、该反应只能在较高温度下才能自发进行 |
| C、该反应在较低温度下能自发进行,高温和催化剂条件只是加快反应的速率 |
| D、汽车尾气中的这两种气体会与人体血红蛋白结合而使人中毒 |
下列反应中,属于取代反应的是( )
| A、乙烯与溴反应制1,2-二溴乙烷 |
| B、苯酚与浓溴水反应生成三溴苯酚 |
| C、甲苯使酸性高锰酸钾溶液褪色 |
| D、在一定条件下苯与氢气反应制取环己烷 |
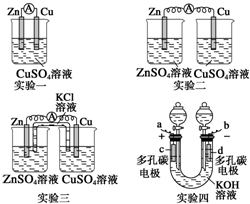 某校化学兴趣小组为了探究原电池工作原理,进行下列实验,请分析实验结果后回答相应问题.
某校化学兴趣小组为了探究原电池工作原理,进行下列实验,请分析实验结果后回答相应问题.