题目内容
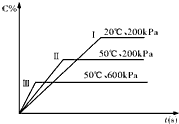 在密闭容器中进行以下可逆反应:A(g)+B(g)?C(g)+2D(?),在不同的条件下C的百分含量的变化情况如如图,则该反应描述正确的是( )
在密闭容器中进行以下可逆反应:A(g)+B(g)?C(g)+2D(?),在不同的条件下C的百分含量的变化情况如如图,则该反应描述正确的是( )| A、正反应放热,D是固体 |
| B、正反应放热,D是气体 |
| C、正反应吸热,D是气体 |
| D、正反应放热,D是固体或气体 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:依据图象分析,相同条件下,先拐先平温度高,压强大,依据ⅠⅡ可知温度越高C%越小,说明升温平衡逆向进行,正反应为放热反应,结合ⅡⅢ,压强越大C%越小,说明增大压强平衡逆向进行,平衡向气体体积减小的方向.
解答:
解:依据图象分析,相同条件下,先拐先平温度高,压强大,依据ⅠⅡ可知温度越高C%越小,说明升温平衡逆向进行,正反应为放热反应,结合ⅡⅢ,压强越大C%越小,说明增大压强平衡逆向进行,增大压强平衡向体积减小的方向,D为气体;
故选B.
故选B.
点评:本题考查了化学平衡图象分析判断,化学平衡移动原理是解题关键,注意图象分析方法,先拐先平温度,压强大,题目难度中等.

练习册系列答案
相关题目
运用元素周期律分析下面的推断正确的是( )
| A、硒化氢是无色、有毒、比硫化氢稳定的气体 |
| B、砹单质是一种有色固体,砹化氢很不稳定,砹化银是难溶于水的白色沉淀 |
| C、硫酸锶难溶于水,但易溶于盐酸 |
| D、铍(Be)是一种轻金属,它的氧化物的水化物可能具有两性 |
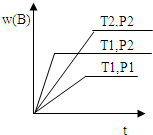 已知某反应aA(g)+bB(g)?cC(g)△H=Q 在密闭容器中进行,在不同温度(T1和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )
已知某反应aA(g)+bB(g)?cC(g)△H=Q 在密闭容器中进行,在不同温度(T1和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )| A、T1<T2,P1<P2,a+b>c,Q>0 |
| B、T1>T2,P1<P2,a+b<c,Q<0 |
| C、T1<T2,P1>P2,a+b<c,Q>0 |
| D、T1<T2,P1>P2,a+b>c,Q<0 |
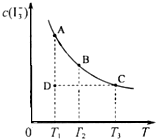 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq) 某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq) 某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )| A、反应I2(aq)+I-(aq)?I3-(aq)的△H>0 |
| B、若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1<K2 |
| C、若反应进行到状态D时,平衡向逆反应方向移动 |
| D、状态B与状态C相比,状态C的c(I2)大 |
在2L密闭容器中加入或通入一定量A、B、C三种物质,在一定条件下发生反应(如图1),3min后给体系加热,气体C的体积分数Ψ(C)和混合气体的平均相对分子质量M均随温度分别发生了图示变化(如图2、图3).下列有关说法不正确的是( )
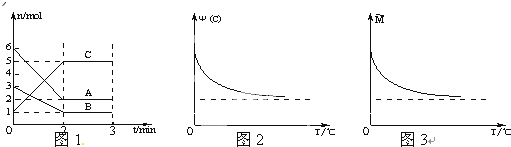

| A、前2min中C的平均反应速率为1mol/L?min |
| B、该反应的化学方程式为:2A+B?2C |
| C、正反应是放热反应 |
| D、A、B一定均为气态 |
当有机物分子中的一个碳原子所连接的四个原子或原子团均不相同时,此碳原子为“手性碳原子”,具有手性碳原子的物质往往具有旋光性,存在对映异构体,如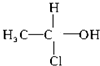 .下列化合物中存在对映异构体的是( )
.下列化合物中存在对映异构体的是( )
 .下列化合物中存在对映异构体的是( )
.下列化合物中存在对映异构体的是( )| A、C2H5CH=CHCH(CH3)-CH=CHC2H5 |
B、 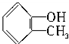 |
| C、甲酸 |
| D、C6H5CH(CH3)OCH3 |
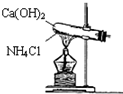 实验室通常用如图所示的装置来制取氨气,(收集装置略).回答下列问题:
实验室通常用如图所示的装置来制取氨气,(收集装置略).回答下列问题:
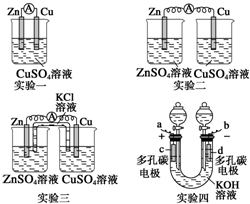 某校化学兴趣小组为了探究原电池工作原理,进行下列实验,请分析实验结果后回答相应问题.
某校化学兴趣小组为了探究原电池工作原理,进行下列实验,请分析实验结果后回答相应问题.