题目内容
9.下列叙述正确的是( )| A. | 离子晶体中,只存在离子键,不可能存在其它化学键 | |
| B. | 氧族元素(O、S、Se、Te)的氢化物的沸点依次升高 | |
| C. | NaHSO4、Na2O2晶体中的阴阳离子个数比均为1:1 | |
| D. | 晶体的硬度:金刚石>碳化硅>石英 |
分析 A.离子晶体中可能含有共价键;
B.分子晶体熔沸点与其相对分子质量成正比,还与氢键有关;
C.NaHSO4、Na2O2晶体中的阴阳离子个数比分别为1:1、1:2;
D.原子晶体硬度与其键长成反比.
解答 解:A.离子晶体中一定含有离子键,也可能存在共价键,如KOH等,故A错误;
B.氧族元素的氢化物都是分子晶体,其熔沸点的高低取决于分子间作用力,水分子之间存在氢键使得其熔沸点特别高,所以氧族元素(O、S、Se、Te)的氢化物的沸点高低顺序是O>Te>Se>S,故B错误;
C.硫酸氢钠是由钠离子和磷酸氢根离子构成的、过氧化钠是由钠离子和过氧根离子构成的,所以NaHSO4、Na2O2晶体中的阴阳离子个数比分别为1:1、1:2,故C错误;
D.原子晶体硬度与其键长成反比,键长C-C<C-Si<Si-Si,所以晶体的硬度:金刚石>碳化硅>石英,故D正确;
故选D.
点评 本题考查化学键与化合物关系、分子晶体熔沸点比较、物质构成、原子晶体等知识点,为高频考点,明确物质结构及其存在的化学键是解本题关键,注意氢化物熔沸点还与氢键有关,但与化学键强弱无关,易错选项是BC.

练习册系列答案
相关题目
20.某化学研究小组在使用FeSO4溶液与NaOH溶液制备Fe(OH)2沉淀过程中观察到生成的白色沉淀迅速转变为灰绿色,最后变为红褐色,该小组针对绿色物质展开研究.
[查阅文献]
(1)写出Fe(OH)2在空气中被氧化为Fe(OH)3的化学方程式6Fe(OH)2+O2+2H2O═2Fe3(OH)8;
[提出假设]假设一:绿色物质是Fe(OH)2•nH2O;
假设二:绿色物质是Fe3(OH)8;
…
[实验探究]针对上述假设与假设二,展开实验研究:
(1)实验室保存FeSO4溶液常需加入Fe、H2SO4(填化学式,下同),为检验某FeSO4溶液是否变质,可向溶液中加入KSCN溶液或NaOH;
(2)由实验一与实验三(填实验序号)的现象可推断假设一可能成立.
(3)为了进一步探究假设二是否成立,小组成员进行如下实验,请完成下表:
试剂:蒸馏水、NaOH溶液、苯、FeSO4溶液、氧气
[查阅文献]
| 文献名称 | 有关Fe(OH)2的描述 |
| 《大学普通化学(下册)》 | 白色沉淀,易被氧化成微绿色Fe3(OH)8 |
| 《化学教育》 | 白色沉淀,在冷水中易形成绿色的水合物Fe(OH)2•nH2O,热水中不易形成水合物 |
[提出假设]假设一:绿色物质是Fe(OH)2•nH2O;
假设二:绿色物质是Fe3(OH)8;
…
[实验探究]针对上述假设与假设二,展开实验研究:
| 实验序号 | 实验步骤 | 实验现象 |
| 一 | ①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②保持较高温度,使用长滴管伸入液面下依次挤入一滴饱和FeSO4溶液、一滴NaOH溶液 | 出现白色絮状沉淀,并能保持一段时间 |
| 二 | ①在试管中加入20mL蒸馏水 ②加入一滴饱和FeSO4溶液、一滴NaOH溶液 | 出现白色沉淀,迅速转变为灰绿色,最后变为红褐色 |
| 三 | ①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②恢复室温后,使用长滴管伸入液面下依次挤入一滴饱和FeSO4溶液、一滴NaOH溶液 | 出现白色沉淀,迅速转变为绿色沉淀 |
(2)由实验一与实验三(填实验序号)的现象可推断假设一可能成立.
(3)为了进一步探究假设二是否成立,小组成员进行如下实验,请完成下表:
试剂:蒸馏水、NaOH溶液、苯、FeSO4溶液、氧气
| 实验步骤 | 实验现象与结论 |
| ①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②迅速用长滴管伸入液面下依次挤入一滴饱和FeSO4 溶液、一滴NaOH溶液 ③将O2缓缓通入白色沉淀中. | 若沉淀中出现绿色的迹象,则假设二成立; 若沉淀中没有出现任何绿色的迹象,则假设二不成立. |
4.下列说法中不正确的是( )
①由同一种元素组成的物质一定是单质
②阴离子一定不含金属元素,阳离子一定含金属元素
③碱性氧化物一定是金属氧化物
④酸性氧化物一定是非金属氧化物
⑤按酸分子中电离出的氢离子数目不同,可将酸分为一元酸、二元酸和多元酸
⑥无氧酸一定是非金属的氢化物.
①由同一种元素组成的物质一定是单质
②阴离子一定不含金属元素,阳离子一定含金属元素
③碱性氧化物一定是金属氧化物
④酸性氧化物一定是非金属氧化物
⑤按酸分子中电离出的氢离子数目不同,可将酸分为一元酸、二元酸和多元酸
⑥无氧酸一定是非金属的氢化物.
| A. | ①③④⑤ | B. | ①②④⑥ | C. | ①②③⑥ | D. | ②③⑤⑥ |
14.下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A. | NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+2c(RO32-) | |
| B. | 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) | |
| C. | 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<② | |
| D. | 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前>N后 |
1.常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
(1)2Fe2++H2O2+2H+═2Fe3++2H2O (2)2Fe3++H2O2═2Fe2++O2↑+2H+
下列说法不正确的是( )
(1)2Fe2++H2O2+2H+═2Fe3++2H2O (2)2Fe3++H2O2═2Fe2++O2↑+2H+
下列说法不正确的是( )
| A. | (1)中H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 | |
| B. | 在反应过程中,溶液的H+浓度不变 | |
| C. | 在反应过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
18.下列溶液中各微粒的浓度关系正确的是( )
| A. | 0.1 mol•L-1 NaHCO3溶液中:[Na+]+[H+]═[HCO3-]+2[CO32-]+[OH-] | |
| B. | 0.1 mol•L-1Na2S溶液中:2[Na+]═[S2-]+[HS-]+[H2S] | |
| C. | 0.1 mol•L-1 NaHSO4溶液中:[Na+]>[SO42-]>[H+]>[OH-] | |
| D. | 等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:[Na+]=[CH3COO-]>[H+]=[OH-] |
3.某药物中间体的合成路线如下.下列说法正确的是( )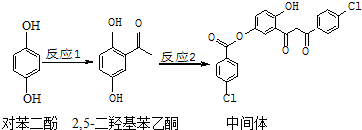

| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1mol该中间体最多可与11 molH2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、取代、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |
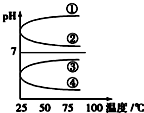 A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、H2SO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、H2SO4中的一种.常温下进行下列实验: