题目内容
14.镉镍可充电池在现代生活中有着广泛的应用,它的充、放电反应如下:Cd+2NiOOH+2H2O$?_{放电}^{充电}$ Cd(OH)2+2Ni(OH)2请回答下列问题:(1)上述反应式中左边物质的总能量大于(填“大于”“小于”或“等于”)右边物质的总能量.
(2)放电时负极发生反应的物质是Cd,放电是正极的反应式为NiOOH+e-+H2O=Ni(OH)2+OH-.
分析 (1)原电池放电是化学能转化为电能的过程;
(2)放电时,该装置是原电池,Cd为负极,电极反应式为Cd-2e-+2OH-=Cd(OH)2,正极反应式为NiOOH+H2O+e-═Ni(OH)2+OH-.
解答 解:(1)原电池放电是化学能转化为电能的过程,放电时的反应物总能量高于生成物,故答案为:大于;
(2)解:由总方程式可知,放电时,该装置是原电池,Cd为负极,正极发生还原反应,NiOOH被还原生成Ni(OH)2,电极方程式为NiOOH+H2O+e-═Ni(OH)2+OH-,
故答案为:Cd;NiOOH+e-+H2O=Ni(OH)2+OH-.
点评 本题考查了化学电源新型电池,根据元素化合价变化确定正负极、阴阳极发生的反应,难点是书写电极反应式,知道正负极与阳极、阴极电极反应式的关系,题目难度中等.

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
4.一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
下列选项正确的是( )
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
下列选项正确的是( )
| A. | CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1 | |
| B. | CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H3>△H1 | |
| C. | 若用0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4 kJ | |
| D. | 若用标准状况下2.24 L CH4还原NO2至N2,整个过程中转移的电子为1.6 mol |
5.能正确表示下列反应的离子方程式是( )
| A. | Fe( N03)3溶液中加入过量HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 浓烧碱溶液中加入铝片:2A1+20H-═2AlO2-+H2 | |
| C. | H2SO4与Ba(OH)2溶液反应:Ba2+OH-+H++SO42-═BaSO4+H2O | |
| D. | 将新制氢氧化铜悬浊液加入氨水中:Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH - |
2.在浅绿色的Fe(NO3)2溶液中存在如下平衡:Fe2++2H2O?Fe(OH)2+2H+,若向该溶液中滴加足量的盐酸,则溶液的颜色( )
| A. | 绿色更浅 | B. | 绿色更深 | C. | 变黄 | D. | 无变化 |
9.化学在生产和日常生活中有重要的作用,下列说法不正确的是( )
| A. | Al2O3可用作耐火材料 | |
| B. | Al(OH3)可用于中和胃酸过多 | |
| C. | Na2O2可用于呼吸面具和潜艇中作氧气的来源 | |
| D. | NaHCO3的水溶液呈碱性,因此NaHCO3不能用作食品添加剂 |


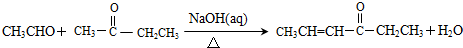
 ,其反应类型是加成反应.
,其反应类型是加成反应.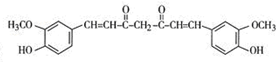 .
.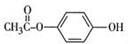 .
.