题目内容
9.全钒液流电池是一种新型的绿色环保储能电池,该电池性能优良,其电池总反应为:V3++VO2++H2O$?_{放电}^{充电}$ VO2++2H++V2+.下列叙述正确的是( )| A. | 放电过程中电解质溶液中阴离子移向正极 | |
| B. | 放电时每转移0.5mol电子,负极有0.5molV2+被氧化 | |
| C. | 充电时阳极附近溶液的酸性减弱 | |
| D. | 充电时阳极反应式为:VO2++2H++e-═VO2++H2O |
分析 根据电池总反应和参加物质的化合价的变化可知,反应中V2+离子被氧化,应是电源的负极,VO2+离子化合价降低,被还原,应是电源的正极反应,根据原电池的工作原理进行分析:
A、电解质溶液中阳离子向正极移动,阴离子向负极移动;
B、放电时氧化剂为VO2+离子,在正极上被还原后生成VO2+离子,根据化合价判断转移的电子数;
C、充电时阳极上发生失电子的氧化反应,根据电极反应式进行回答;
D、充电时阳极上发生失电子的氧化反应.
解答 解:电池总反应和参加物质的化合价的变化可知,反应中V2+离子被氧化,应是电源的负极,VO2+离子化合价降低,被还原,应是电源的正极反应.
A、电解质溶液中阳离子向正极移动,阴离子向负极移动,故A错误;
B、放电时氧化剂为VO2+离子,在正极上被还原后生成VO2+离子,每转移2mol电子时,消耗2mol氧化剂,转移0.5mol电子,负极有0.5molV2+被氧化,故B正确;
C、充电时阳极发生反应:H2O+VO2+-e-=VO2++2H+,生成氢离子,所以溶液的酸性增强,故C错误;
D、充电时阳极上发生失电子的氧化反应,即H2O+VO2+-e-=VO2++2H+,故D错误.
故选B.
点评 本题考查原电池的工作原理,题目难度不大,注意把握原电池中电子及溶液中离子的定向移动问题,本题从化合价的变化进行判断是做题的关键.

练习册系列答案
 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
19.1923年以前,甲醇一般是用木材或其废料的分解蒸馏来生产的.现在工业上合成甲醇几乎全部采用一氧化碳或二氧化碳加压催化加氢的方法,工艺过程包括造气、合成净化、甲醇合成和粗甲醇精馏等工序.
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
(1)反应②是吸热(填“吸热”或“放热”)反应.
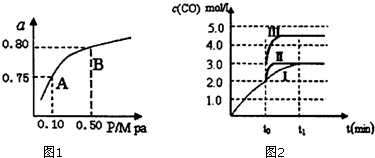
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1×K2(用K1、K2表示).
(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积(快速)压缩至2L.
(4)甲醇燃料电池有着广泛的用途,若采用铂为电极材料,两极上分别通入甲醇和氧气,以氢氧化钾溶液为电解质溶液,则该碱性燃料电池的负极反应式是CH3OH-6 e-+8 OH-=CO32-+6 H2O;
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1×K2(用K1、K2表示).
(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积(快速)压缩至2L.
(4)甲醇燃料电池有着广泛的用途,若采用铂为电极材料,两极上分别通入甲醇和氧气,以氢氧化钾溶液为电解质溶液,则该碱性燃料电池的负极反应式是CH3OH-6 e-+8 OH-=CO32-+6 H2O;

17.根据键能数据估算CH4(g)+4F2(g)═CF4+4HF(g)的反应热△H为( )
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ/mol) | 414 | 489 | 565 | 155[ |
| A. | -1940kJ•mol-1 | B. | +1940kJ•mol-1 | C. | -485kJ•mol-1 | D. | +485kJ•mol-1 |
4.一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
下列选项正确的是( )
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
下列选项正确的是( )
| A. | CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1 | |
| B. | CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H3>△H1 | |
| C. | 若用0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4 kJ | |
| D. | 若用标准状况下2.24 L CH4还原NO2至N2,整个过程中转移的电子为1.6 mol |
18.下列有关气体摩尔体积的描述中正确的是( )
| A. | 相同物质的量的气体,其气体摩尔体积也相同 | |
| B. | 气体摩尔体积是指1mol任何气体所占的体积为22.4L | |
| C. | 标准状况下的气体摩尔体积约为22.4L/mol | |
| D. | 一定物质的量的气体所占的体积就是气体摩尔体积 |

 开发利用清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题.甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)?CH3OH(g)△H=-105kJ•mol-1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
开发利用清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题.甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)?CH3OH(g)△H=-105kJ•mol-1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示: ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为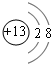 .
.