题目内容
6.对于可逆反应A(g)+2B(g)?2C(g)△H>0,下列图象中正确的是( )| A. | 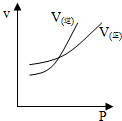 | B. | 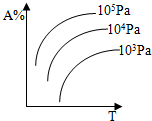 | ||
| C. | 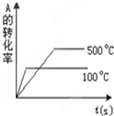 | D. | 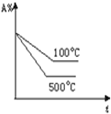 |
分析 可逆反应A(g)+2B(g)?2C(g)△H>0,反应物气体的化学计量数之和大于生成物气体的化学计量数,增大压强,平衡向正反应方向移动,正反应吸热,升高温度平衡向正反应方向移动,以此解答该题.
解答 解:A.增大压强,平衡向正反应方向移动,正反应速率大于逆反应速率,故A错误;
B.正反应吸热,升高温度平衡向正反应方向移动,A的百分含量减小,故B错误;
C.升高温度,反应速率增大,达到平衡所用时间较少,图象不符合,故C错误;
D.升高温度,反应速率增大,达到平衡所用时间较少,平衡向正反应方向移动,A的含量减小,故D正确.
故选D.
点评 本题考查化学反应平衡图象问题,题目难度中等,注意分析方程式的特征来判断温度、压强对平衡移动的影响为解答该题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.某温度下,0.200mol•L-1的HA溶液与0.200mol•L-1的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如下表,下列说法正确的是( )
| 微粒 | X | Y | Na+ | A- |
| 浓度/(mol•L-1) | 8.00×10-4 | 2.50×10-10 | 0.100 | 9.92×10-2 |
| A. | 0.1mol•L-1HA溶液的pH=1 | B. | 该温度下Kw=1.0×10-14 | ||
| C. | 微粒X表示OH-,Y表示H+ | D. | 混合溶液中:n(A-)+n(X)=n(Na+) |
14.将pH试纸用蒸馏水湿润后,去测定某盐酸的pH,测得的pH将比实际( )
| A. | 偏高 | B. | 偏低 | ||
| C. | 不变 | D. | 三种情况均有可能 |
11.工业上制备氯化铜时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO+2HCl═CuCl2+H2O FeO+2HCl═FeCl2+H2O
已知:pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是( )
CuO+2HCl═CuCl2+H2O FeO+2HCl═FeCl2+H2O
已知:pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是( )
| A. | 直接加碱,调整溶液pH≥9.6 | |
| B. | 加足量的铜粉,将Fe2+还原出来 | |
| C. | 加足量的锌粉,将Fe2+还原出来 | |
| D. | 先将Fe2+氧化成Fe3+,再调整pH在3~4 |
18.下列说法正确的是( )
| A. | 以极性键结合起来的分子一定是极性分子 | |
| B. | 非极性分子中,一定含有非极性共价键 | |
| C. | 乙醇分子和水分子间只存在范德华力 | |
| D. | 卤素单质按F2→I2,熔沸点逐渐升高 |
15.下列各组物质相互混合反应,既有气体生成最终又有沉淀生成的组合完全正确的是( )
①Ba(HCO3)2与稀H2SO4混合
②金属钠投入到FeCl3溶液中
③Na2O2投入到 Ba(NO3)2溶液混合
④Na2O2固体投入到CuSO4溶液.
①Ba(HCO3)2与稀H2SO4混合
②金属钠投入到FeCl3溶液中
③Na2O2投入到 Ba(NO3)2溶液混合
④Na2O2固体投入到CuSO4溶液.
| A. | ①②④ | B. | ③ | C. | ①② | D. | ①②③④ |
16.下列叙述正确的是(NA为阿伏加德罗常数的值)( )
| A. | 1 mol Na2SiO3中含有NA个Na2O | |
| B. | 在H2O2+Cl2═2HCl+O2反应中,每生成32 g氧气,则转移NA个电子 | |
| C. | 标准状况下,分子数为NA的CO、C2H4混合气体体积约22.4 L,质量为28 g | |
| D. | 4.6 g Na与适量氧气完全反应生成Na2O、Na2O2,反应中转移的电子数为0.1NA |
 .
.