题目内容
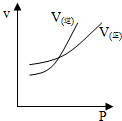
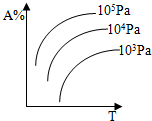
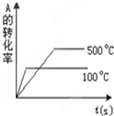
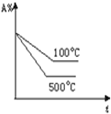
14.将pH试纸用蒸馏水湿润后,去测定某盐酸的pH,测得的pH将比实际( )| A. | 偏高 | B. | 偏低 | ||
| C. | 不变 | D. | 三种情况均有可能 |
分析 将pH试纸用蒸馏水湿润后,将对盐酸溶液造成稀释,则导致氢离子浓度降低,据此分析.
解答 解:pH试纸已经用蒸馏水湿润,稀释了待测的盐酸溶液,导致氢离子浓度降低,故所测pH要增大,故选A.
点评 本题考查了用pH试纸测溶液pH的正确的操作方法,应注意的是pH试纸在使用时不能润湿.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.某氢氧固体酸燃料电池的总反应为:2H2+O2=2H2O,其基本结构如图所示:
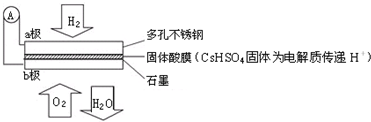
下列有关说法不正确的是( )

下列有关说法不正确的是( )
| A. | 电子通过外电路从a极流向b极 | |
| B. | H+由a极通过固体酸电解质传递到b极 | |
| C. | 电池工作时每转移0.1 mol电子,消耗1.12 LH2 | |
| D. | b极上的电极反应式为:O2+4H++4e-=2H2O |
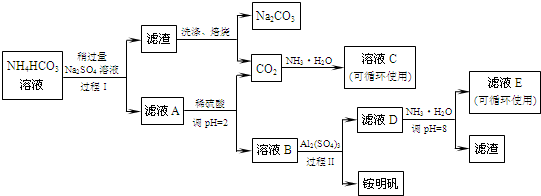
8.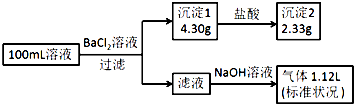 某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )
某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )
 某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )
某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )| A. | 原溶液一定存在CO32-和SO42-,一定不存在Fe3+ | |
| B. | 原溶液一定存在Cl-,可能存在Na+ | |
| C. | 原溶液中c(Cl-)≥0.1mol•L-1 | |
| D. | 若原溶液中不存在Na+,则c(Cl-)<0.1mol•L-1 |
9.阿司匹林(乙酰水杨酸,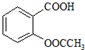 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如图1:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如图1:
主要试剂和产品的物理常数
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是防止乙酸酐水解;
(2)写出制备阿司匹林的化学方程式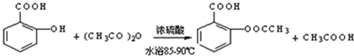 ;
;
(3)①合成阿斯匹林时,最合适的加热方法是水浴加热;
②过滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是关闭水龙头,向漏斗中加冰水至浸没沉淀物,使洗涤剂缓慢通过沉淀物,重复上述操作2-3次;
(4)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再过滤,则加饱和NaHCO3溶液的目的是使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,便于与聚合物分离;
另一种改进的提纯方法,称为重结晶提纯法.方法如下:
[粗产品]$→_{沸石}^{乙酸乙酯}$ $→_{回流}^{加热}$ $\stackrel{趁热过滤}{→}$ $→_{抽滤}^{冷却}$ $→_{干燥}^{洗涤}$[乙酰水杨酸]
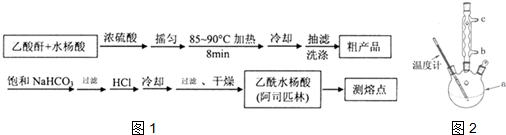
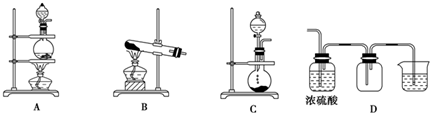
(5)改进的提纯方法中加热回流的装置如2图所示,使用温度计的目的是控制反应温度,防止温度过高,避免乙酰水杨酸受热分解;冷凝水的流进方向是b(填“b”或“c”)
(6)检验产品中是否含有水杨酸的试剂是FeCl3溶液;
(7)该学习小组在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品m=2.2g,则所得乙酰水杨酸的产率为84.3%.
 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如图1:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如图1:
主要试剂和产品的物理常数
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸 | 102 | 139.4(沸点) | 反应 |
| 乙酸水杨酸 | 180 | 135(熔点) | 微溶 |
(1)制备阿司匹林时,要使用干燥的仪器的原因是防止乙酸酐水解;
(2)写出制备阿司匹林的化学方程式
 ;
;(3)①合成阿斯匹林时,最合适的加热方法是水浴加热;
②过滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是关闭水龙头,向漏斗中加冰水至浸没沉淀物,使洗涤剂缓慢通过沉淀物,重复上述操作2-3次;
(4)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再过滤,则加饱和NaHCO3溶液的目的是使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,便于与聚合物分离;
另一种改进的提纯方法,称为重结晶提纯法.方法如下:
[粗产品]$→_{沸石}^{乙酸乙酯}$ $→_{回流}^{加热}$ $\stackrel{趁热过滤}{→}$ $→_{抽滤}^{冷却}$ $→_{干燥}^{洗涤}$[乙酰水杨酸]
(5)改进的提纯方法中加热回流的装置如2图所示,使用温度计的目的是控制反应温度,防止温度过高,避免乙酰水杨酸受热分解;冷凝水的流进方向是b(填“b”或“c”)
(6)检验产品中是否含有水杨酸的试剂是FeCl3溶液;
(7)该学习小组在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品m=2.2g,则所得乙酰水杨酸的产率为84.3%.
3.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 1.0mol/L Na2CO3溶液:c(H2CO3)+c(HCO3-)+2 c(CO32-)=1.0mol/L | |
| B. | 1.0mol/L Na2CO3溶液:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) |
4.化学与生产、生活密切相关.下列说法不正确的是( )
| A. | 食盐可作调味剂,也可用作食品防腐剂 | |
| B. | 二氧化硫可用于制作葡萄酒的食品添加剂 | |
| C. | 还原铁粉和生石灰均可用作食品包装袋内的脱氧剂 | |
| D. | “地沟油”禁止食用,但可用来制取肥皂 |
 .
.