题目内容
2. 四种常见元素的性质或结构信息如表.试根据信息回答有关问题.
四种常见元素的性质或结构信息如表.试根据信息回答有关问题.| 元素 | A | B | C | D |
| 性质 结构 信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(2)B元素的低价氧化物分子中心原子的杂化方式为sp2杂化
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点低(填“高”或“低”),其原因是晶体类型不同,二氧化碳形成分子晶体,二氧化硅形成原子晶体;
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为先生成蓝色沉淀,后沉淀溶解生成深蓝色溶液;请写出上述过程的离子方程式:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
(5)C晶体的堆积方式如图所示,设C原子半径为r cm,阿伏伽德罗常数用NA表示,C晶体的堆积模型为面心立方最密堆积,C晶体的密度为$\frac{16}{\sqrt{2}{r}^{3}{N}_{A}}$ g•cm-3(要求写表达式,可以不化简).晶胞中原子空间利用率为74% (要求写表达式,可以不化简).
分析 A原子核外有两个电子层,最外层有3个未成对的电子,原子核外电子排布式为1s22s22p3,则A为氮元素;B原子的M层有1对成对的p电子,外围电子排布为3s23p4,则B为硫元素;C原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价,则C为Cu;D元素有种常见氧化物,其中有一种是冶金工业常用的还原剂,则D为C元素,据此解答.
解答 解:A原子核外有两个电子层,最外层有3个未成对的电子,原子核外电子排布式为1s22s22p3,则A为氮元素;B原子的M层有1对成对的p电子,外围电子排布为3s23p4,则B为硫元素;C原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价,则C为Cu;D元素有种常见氧化物,其中有一种是冶金工业常用的还原剂,则D为C元素,
(1)同周期随原子序数增大第一电离能呈增大趋势,N元素2p轨道容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能由大到下的顺序为N>O>C,
故答案为:N>O>C;
(2)S元素的低价氧化物为SO2,分子中S原子价层电子对数=2+$\frac{6-2×2}{2}$=3,S原子采取sp2杂化,
故答案为:sp2杂化;
(3)二氧化碳形成分子晶体,二氧化硅形成原子晶体,故二氧化碳晶体熔点比较二氧化硅低,
故答案为:低;晶体类型不同,二氧化碳形成分子晶体,二氧化硅形成原子晶体;
(4)往硫酸铜溶液中逐滴加入过量氨水,先生成氢氧化铜沉淀,后氢氧化铜溶解氨水得到四氨合铜络离子,观察到的现象为:先生成蓝色沉淀,后沉淀溶解生成深蓝色溶液,上述过程的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,
故答案为:先生成蓝色沉淀,后沉淀溶解生成深蓝色溶液;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(5)C为Cu,由Cu晶体的堆积方式可知,为面心立方最密堆积,晶胞中Cu原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Cu原子半径为r,晶胞棱长=4r×$\frac{\sqrt{2}}{2}$=2 $\sqrt{2}$r,故晶胞体积=(2 $\sqrt{2}$r)3=16 $\sqrt{2}$r3,晶胞的空间利用率=$\frac{4×\frac{4}{3}π{r}^{3}}{16\sqrt{2}{r}^{3}}$×100%=74%,
故晶胞的密度ρ=$\frac{m}{V}$=$\frac{\frac{4×64}{NA}}{16\sqrt{2}{r}^{3}}$=$\frac{16}{\sqrt{2}{r}^{3}{N}_{A}}$g•cm-3,
故答案为:面心立方最密堆积; $\frac{16}{\sqrt{2}{r}^{3}{N}_{A}}$;74%.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、分子结构、晶体类型与性质、配合物、晶胞结构与计算等,侧重考查主干知识,(5)中关键是计算晶胞的体积,难度中等.

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案| A. | CaCl2 MgCl2 Na2O | B. | H2O Na2O ?CO2 | ||
| C. | CaCl2 ?NaOH H2SO4 | D. | NH4Cl H2O CO2 |
| A. | NH3易液化,液氨常用作制冷剂 | |
| B. | 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 | |
| C. | 氨盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处 | |
| D. | 稀HNO3和活泼金属反应时不能得到氢气 |
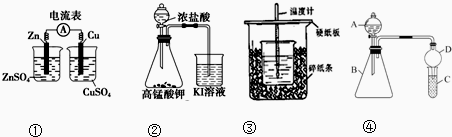
| A. | 装置①:检验电流的方向 | |
| B. | 装置②:探究氧化性:KMnO4>Cl2>I2 | |
| C. | 装置③:测定中和热 | |
| D. | 装置④:A、B、C中分别加入HCl、Na2CO3、Na2SiO3判断Cl、C、Si的非金属性 |
| A. | SiH4的空间构型是正四面体 | |
| B. | 在NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| C. | 原子晶体中原子以共价键结合,具有键能大、硬度大的特性 | |
| D. | SO2、SO3都是极性分子 |
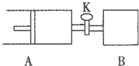 如图向A、B中均充入1molX、1moIY,起始时A、B的体积相等都等于aL.在相同温度压强和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.达平衡时,A的体积为1.4aL.下列说法错误的是( )
如图向A、B中均充入1molX、1moIY,起始时A、B的体积相等都等于aL.在相同温度压强和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.达平衡时,A的体积为1.4aL.下列说法错误的是( )| A. | 反应速率:v(B)>v(A) | |
| B. | A容器中X的转化率为80% | |
| C. | 平衡时的压强:PB=PA | |
| D. | 平衡时向A容器中充入与反应无关的气体M,能减慢A容器内化学反应的速率 |