题目内容
12.下列各组物质中化学键的类型相同的是( )| A. | CaCl2 MgCl2 Na2O | B. | H2O Na2O ?CO2 | ||
| C. | CaCl2 ?NaOH H2SO4 | D. | NH4Cl H2O CO2 |
分析 一般来说,活泼金属和活泼非金属元素易形成离子键,非金属元素之间易形成共价键,以此来解答.
解答 解:A.CaCl2中只含离子键,MgCl2 中只含有离子键,Na2O中氧离子和钠离子之间存在离子键,化学键类型相同,故A选;
B.Na2O中氧离子和钠离子之间存在离子键,CO2、H2O中均只含极性共价键,化学键类型不相同,故B不选;
C.CaCl2中只含离子键,NaOH中含离子键和O-H共价键,H2SO4中只含有共价键,故C不选;
D.NH4Cl中氯离子和铵根离子之间存在离子键,N与H之间存在共价键;CO2、H2O中均只含极性共价键,化学键类型不相同,故D不选;
故选A.
点评 本题考查化学键,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案
相关题目
2.为探究外界条件对H2 (g)+I2 (g)?2HI (g)△H>0 反应速率的影响,设计下表所示实验
(1)完成上表中的空格.
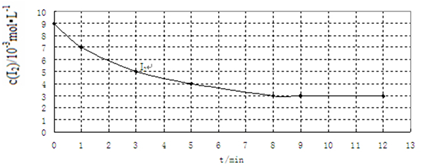
(2)实验Ⅰ中,I2的物质的量浓度(c)随时间(t)的变化如图所示.根据图中数据回答下列问题:
①在0~5min内反应的平均速率ν(I2)=1×10-3mol•L-1•min-1.
②在给出的坐标图中画出实验Ⅱ、Ⅲ中I2的物质的量浓度(c)随时间(t)变化的曲线,并进行必要的标注.
③该同学想用此反应研究压强对化学平衡移动的影响,请问能否达到实验目的?请说明原因.不能(填“能”、不能”),原因是该反应前后气体计量数相等,平衡不受压强的影响.
| 实验 编号 | 实验目的 | 温度/℃ | 催化剂 质量/g | 反应物初始浓度 /10-3mol•L-1 | |
| H2 | I2 | ||||
| Ⅰ | 为以下实验作参照 | 457 | 0 | 7 | 9 |
| Ⅱ | 420 | 7 | 9 | ||
| Ⅲ | 探究催化剂对该反应速率的影响 | 10 | 7 | 9 | |
(2)实验Ⅰ中,I2的物质的量浓度(c)随时间(t)的变化如图所示.根据图中数据回答下列问题:
①在0~5min内反应的平均速率ν(I2)=1×10-3mol•L-1•min-1.
②在给出的坐标图中画出实验Ⅱ、Ⅲ中I2的物质的量浓度(c)随时间(t)变化的曲线,并进行必要的标注.
③该同学想用此反应研究压强对化学平衡移动的影响,请问能否达到实验目的?请说明原因.不能(填“能”、不能”),原因是该反应前后气体计量数相等,平衡不受压强的影响.

3.某原电池的电极反应式为:Fe-2e-═Fe2+,该原电池材料及电解质溶液可能是( )
| A | B | C | D | |
| 正极 | Fe | Fe | C | Cu |
| 负极 | Cu | Zn | Fe | Zn |
| 电解质溶液 | HCl | CuSO4 | CuSO4 | FeSO4 |
| A. | A | B. | B | C. | C | D. | D |
20.一定温度下,在一恒容密闭容器中,发生反应:N2+3H2?2NH3,下列能说明反应已达到平衡状态的是( )
①体系的压强不变
②体系的密度不变
③各组分的物质的量浓度不变
④各组分的质量分数不变
⑤反应速率V(N2):V(H2)=1:3
⑥混合气体的总物质的量不变
⑦混合气体的平均相对分子质量不变
⑧一个N≡N键断裂的同时,有2个N-H键的断裂
⑨C(N2):C(H2):C(NH3)=1:3:2.
①体系的压强不变
②体系的密度不变
③各组分的物质的量浓度不变
④各组分的质量分数不变
⑤反应速率V(N2):V(H2)=1:3
⑥混合气体的总物质的量不变
⑦混合气体的平均相对分子质量不变
⑧一个N≡N键断裂的同时,有2个N-H键的断裂
⑨C(N2):C(H2):C(NH3)=1:3:2.
| A. | ①③④⑥⑦ | B. | ②③⑤⑧⑨ | C. | ②③⑥⑦⑨ | D. | ①④⑤⑧⑨ |
7.分离苯和苯酚的混合物,通常采用的方法是( )
| A. | 振荡混合物,用分液漏斗分离 | |
| B. | 加入NaOH溶液后振荡,用分液漏斗分离;取下层液体通入CO2,待分层后分液 | |
| C. | 加水振荡后用分液漏斗分离 | |
| D. | 加稀盐酸振荡后,用分液漏斗分离 |
17. 始祖鸟烯形状宛如一只展翅低头飞翔的鸟,其键线式结构表示如图,其中R 1、R 2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )
始祖鸟烯形状宛如一只展翅低头飞翔的鸟,其键线式结构表示如图,其中R 1、R 2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )
 始祖鸟烯形状宛如一只展翅低头飞翔的鸟,其键线式结构表示如图,其中R 1、R 2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )
始祖鸟烯形状宛如一只展翅低头飞翔的鸟,其键线式结构表示如图,其中R 1、R 2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )| A. | 始祖鸟烯与乙烯互为同系物 | |
| B. | 若R 1=R 2=甲基,则其化学式为C 12H 16 | |
| C. | 若R 1=R 2=甲基,则始祖鸟烯的一氯代物有3种 | |
| D. | 始祖鸟烯既能使酸性高锰酸钾溶液褪色,也能使溴水褪色,则两反应的反应类型是相同的 |
4.下列物质的电子式正确的是( )
| A. | 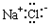 | B. | 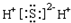 | C. |  | D. | 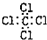 |
2. 四种常见元素的性质或结构信息如表.试根据信息回答有关问题.
四种常见元素的性质或结构信息如表.试根据信息回答有关问题.
(1)元素A与其同周期相邻两种元素原子的第一电离能由大到小的顺序为N>O>C(用元素符号表示);
(2)B元素的低价氧化物分子中心原子的杂化方式为sp2杂化
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点低(填“高”或“低”),其原因是晶体类型不同,二氧化碳形成分子晶体,二氧化硅形成原子晶体;
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为先生成蓝色沉淀,后沉淀溶解生成深蓝色溶液;请写出上述过程的离子方程式:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
(5)C晶体的堆积方式如图所示,设C原子半径为r cm,阿伏伽德罗常数用NA表示,C晶体的堆积模型为面心立方最密堆积,C晶体的密度为$\frac{16}{\sqrt{2}{r}^{3}{N}_{A}}$ g•cm-3(要求写表达式,可以不化简).晶胞中原子空间利用率为74% (要求写表达式,可以不化简).
 四种常见元素的性质或结构信息如表.试根据信息回答有关问题.
四种常见元素的性质或结构信息如表.试根据信息回答有关问题.| 元素 | A | B | C | D |
| 性质 结构 信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(2)B元素的低价氧化物分子中心原子的杂化方式为sp2杂化
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点低(填“高”或“低”),其原因是晶体类型不同,二氧化碳形成分子晶体,二氧化硅形成原子晶体;
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为先生成蓝色沉淀,后沉淀溶解生成深蓝色溶液;请写出上述过程的离子方程式:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
(5)C晶体的堆积方式如图所示,设C原子半径为r cm,阿伏伽德罗常数用NA表示,C晶体的堆积模型为面心立方最密堆积,C晶体的密度为$\frac{16}{\sqrt{2}{r}^{3}{N}_{A}}$ g•cm-3(要求写表达式,可以不化简).晶胞中原子空间利用率为74% (要求写表达式,可以不化简).