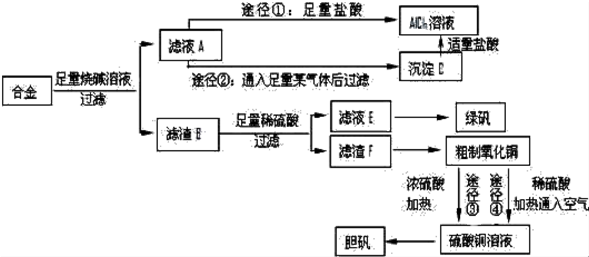
题目内容
12.常温下,下列关于0.1mol/L NH4Cl溶液的说法正确的是②⑤⑦⑧⑨①c(NH4+)=0.1mol•L-1;
②溶液中c(H+)•c(OH-)=1.0×10-14;
③水电离出来的c(H+)=c(OH-);
④溶液的pH=1;
⑤c(OH-)=c(NH4+)+c(H+)-c(Cl-)
⑥升高温度,溶液的pH增大
⑦加热蒸干溶液,将得不到固体物质
⑧c(NH4+)+c(NH3•H2O)=0.1mol•L-1
⑨c(OH-)+c(NH3•H2O)=c(H+)
⑩NH4Cl水解的离子方程式为:NH4++OH-?NH3•H2O.
分析 ①氯化铵溶液中铵根离子水解溶液显酸性;
②温度不变溶液中存在离子积常数;
③铵根离子结合水电离出的氢氧根离子,促进水电离平衡正向进行;
④溶液中铵根离子水解显酸性,溶液中氢离子浓度远远小于0.1mol/L;
⑤氯化铵溶液中存在电荷守恒;
⑥升温促进铵根离子的水解,溶液酸性增强;
⑦氯化铵溶液蒸发促进水解正向进行,随蒸发氯化氢挥发一水合氨分解最后无固体剩余;
⑧溶液中存在物料守恒,氮元素存在形式总和等于氯离子浓度;
⑨溶液中存在质子守恒分析;
⑩氯化铵溶液中铵根离子水解溶液显酸性.
解答 解:①氯化铵溶液中铵根离子水解溶液显酸性,c(NH4+)<0.1mol•L-1,故①错误;
②温度不变溶液中存在离子积常数,溶液中c(H+)•c(OH-)=1.0×10-14,故②正确;
③铵根离子结合水电离出的氢氧根离子,促进水电离平衡正向进行,溶液中水电离出来的c(H+)大于溶液中c(OH-),故③错误;
④溶液中铵根离子水解显酸性,溶液中氢离子浓度远远小于0.1mol/L,溶液的pH>1,故④错误;
⑤氯化铵溶液中存在电荷守恒,c(OH-)+c(Cl-)=c(NH4+)+c(H+),故⑤正确;
⑥升温促进铵根离子的水解,溶液酸性增强,升高温度,溶液的pH减小,故⑥错误;
⑦氯化铵溶液蒸发促进水解正向进行,随蒸发氯化氢挥发一水合氨分解最后无固体剩余,加热蒸干溶液,将得不到固体物质,故⑦正确;
⑧溶液中存在物料守恒,氮元素存在形式总和等于氯离子浓度,c(NH4+)+c(NH3•H2O)=0.1mol•L-1,故⑧正确;
⑨溶液中存在质子守恒分析,c(OH-)+c(NH3•H2O)=c(H+),故⑨正确;
⑩氯化铵溶液中铵根离子水解溶液显酸性,NH4Cl水解的离子方程式为:NH4++H2O?NH3•H2O+OH-,故⑩错误;
故正确的为②⑤⑦⑧⑨,
故答案为:②⑤⑦⑧⑨.
点评 本题考查了电解质溶液中水解平衡、离子浓度大小比较、电荷守恒、物料守恒、质子守恒等知识点,掌握基础是解题关键,题目难度中等.

 四种常见元素的性质或结构信息如表.试根据信息回答有关问题.
四种常见元素的性质或结构信息如表.试根据信息回答有关问题.| 元素 | A | B | C | D |
| 性质 结构 信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(2)B元素的低价氧化物分子中心原子的杂化方式为sp2杂化
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点低(填“高”或“低”),其原因是晶体类型不同,二氧化碳形成分子晶体,二氧化硅形成原子晶体;
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为先生成蓝色沉淀,后沉淀溶解生成深蓝色溶液;请写出上述过程的离子方程式:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
(5)C晶体的堆积方式如图所示,设C原子半径为r cm,阿伏伽德罗常数用NA表示,C晶体的堆积模型为面心立方最密堆积,C晶体的密度为$\frac{16}{\sqrt{2}{r}^{3}{N}_{A}}$ g•cm-3(要求写表达式,可以不化简).晶胞中原子空间利用率为74% (要求写表达式,可以不化简).
| A. | 乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 苯与溴水混合,反复振荡后溴水层颜色变浅 | |
| C. | 油脂使溴的四氯化碳溶液褪色 | |
| D. | 甲烷与氯气混合,光照一段时间后黄绿色消失 |
| A. |  | B. |  | ||
| C. | CH3CH2COOH | D. |  |
| A. | 标准状况下,11.2L甲烷中含有的碳氢键数目为2NA | |
| B. | 常温下,1L0.1mol/L的Na2CO3溶液中含有OH-离子数为0.1NA | |
| C. | 常温常压下,28gN2、CO的混合气体中含有N2分子数为0.5NA | |
| D. | 标准状况下,22.4LCl2与足量NaOH溶液反应,转移的电子数为2NA |
| A. | Cl2 | B. | NH3 | C. | FeSO4 | D. | 蔗糖 |
请回答下列问题:
(1)请完成以下表格(表中不要留有空格):
| 实验编号 | 实验目的 | 温度 | 废水样品 | 2.0mLH2C2O4的浓度 |
| ① | 为以下实验作参照 | 273K | 4.0mL | 0.10mol?L-1 |
| ② | 298K | 4.0mL | 0.10mol?L-1 | |
| ③ | 探究浓度对反应速率的影响 | 273K | 0.20mol?L-1 |
2MnO4-+5H2C2O4+6H+═2Mn2++8H2O+10CO2↑.
(3)某课题组对摩尔氏盐[FeSO4?(NH4)2SO4?6H2O]中起加快溶液紫红色褪去的成分提出如下假设,请你完成假设二、假设三:
假设一:SO42- 起催化作用.;
假设二:Fe2+起还原作用或起催化作用;
假设三:NH4+起还原作用或起催化作用.
(4)请你设计实验验证上述假设一是否成立,完成下表中的内容.
| 实验方案(不要求写具体操作过程) | 预期的实验现象和结论 |
| 取等量的废水样品于两支试管中,… |
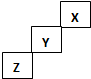
| A. | Z一定是活泼的金属元素 | |
| B. | X的最高价氧化物的水化物是一种强酸 | |
| C. | Y的气态氢化物最稳定 | |
| D. | Z单质可与盐酸反应置换出氢气 |