题目内容
下列含氧酸中酸性最强的是( )
| A、H3PO4 |
| B、H3AsO4 |
| C、HNO3 |
| D、HClO |
考点:物质的结构与性质之间的关系
专题:
分析:含氧酸可用通式XOm(OH)n来表示,式中m大于等于2的是强酸,m为0的是弱酸,据此可知,非羟基氧原子数目越大,酸性越强,将选项中含氧酸改写成XOm(OH)n形式,根据非羟基氧原子数目判断.
解答:
解:A、H3PO4可以为PO(OH)3,非羟基氧原子数目为1,
B、H3AsO4可以改写为AsO1(OH)3,非羟基氧原子数目为1;
C、HNO3可以改写为NO2(OH)1,非羟基氧原子数目为2;
D、HClO可以改写为Cl(OH)1,非羟基氧原子数目为0;
HNO3中非羟基氧原子数目最多,酸性最强,
故选C.
B、H3AsO4可以改写为AsO1(OH)3,非羟基氧原子数目为1;
C、HNO3可以改写为NO2(OH)1,非羟基氧原子数目为2;
D、HClO可以改写为Cl(OH)1,非羟基氧原子数目为0;
HNO3中非羟基氧原子数目最多,酸性最强,
故选C.
点评:本题考查了酸性强弱比较,根据含氧酸可用通式XOm(OH)n来表示,式中m大于等于2的是强酸,m为0的是弱酸,非羟基氧原子数目越大,酸性越强进行判断,本题难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
将10mL 5mol/L的HCl溶液稀释到200mL,从中取出5mL,这5mL溶液的物质的量浓度为( )
| A、0.5mo/L |
| B、0.25mol/L |
| C、0.1mol/L |
| D、1mol/L |
某密闭容器中充入等物质的量的A和B,一定温度下发生反应:A(g)+xB(g)?2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物质的量浓度、反应速率随时间的变化如图所示:下列说法中正确的是( )


| A、前8minA的平均反应速率为0.08mol?L-1min-1 |
| B、反应方程式中的x=1,正反应为吸热反应 |
| C、30min时降低温度,40min时升高温度 |
| D、30-40min之间该反应增大了压强或使用了催化剂 |
下列各项比较中前者高于(或大于或强于)后者的是( )
| A、CCl4和SiCl4的熔点 |
| B、I2在水中的溶解度和I2在CCl4溶液中的溶解度 |
C、对羟基苯甲醛(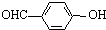 )和邻羟基苯甲醛( )和邻羟基苯甲醛(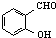 )的沸点 )的沸点 |
| D、H2SO3和H2SO4的酸性 |
下列物质中,属于电解质的是( )
| A、CO2 |
| B、Cu |
| C、NaCl |
| D、酒精 |

 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表: