题目内容
 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
(2)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式
(3)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解.向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中D单质的质量分数为
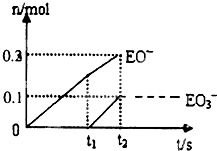
(4)一定量的石灰乳中通人一定量的E单质.两者恰好完全反应,生成物中有三种含E元素的离子.其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.则t2时刻消耗氢氧化钙质量为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A的单质是密度最小的物质,故A是氢元素;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,且B是短周期元素,所以B是钠元素;C的原子最外层电子数是其内层电子数的三倍,且C是短周期元素,所以C是氧元素;D与B同周期,该周期中D的简单离子半径最小,故D是铝元素;B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分,消毒剂的主要成分是次氯酸钠,所以E是氯元素;F元素最高正价与最低负价的代数和为4,且F是短周期元素,所以F是硫元素,据此答题.
解答:
解:A的单质是密度最小的物质,故A是氢元素;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,且B是短周期元素,所以B是钠元素;C的原子最外层电子数是其内层电子数的三倍,且C是短周期元素,所以C是氧元素;D与B同周期,该周期中D的简单离子半径最小,故D是铝元素;B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分,消毒剂的主要成分是次氯酸钠,所以E是氯元素;F元素最高正价与最低负价的代数和为4,且F是短周期元素,所以F是硫元素,
(1)铝离子的电子层数小于硫离子、氯离子的电子层数,电子层数越多,离子半径越大,所以铝离子半径小于氯离子和硫离子半径;电子层数相同的离子,离子半1随着原子序数的增大而减小,所以硫离子半径大于氯离子半径,则为S2->Cl->Al3+,
故答案为:S2->Cl->Al3+;
(2)两种均含A、B、C、F四种元素的化合物分别为硫酸氢钠和亚硫酸氢钠,硫酸氢钠溶液呈强酸性,亚硫酸氢钠是弱酸酸式盐,所以硫酸氢钠和亚硫酸氢钠反应产生硫酸钠、水和二氧化硫,反应的离子方程式为H++HSO3-=SO2↑+H2O,
故答案为:H++HSO3-=SO2↑+H2O;
(3)铁和铝的混合物加入足量稀硫酸后生成硫酸亚铁和硫酸铝,向硫酸亚铁和硫酸铝溶液中加入过量氢氧化钠溶液后生成氢氧化亚铁沉淀和偏铝酸钠溶液,沉淀经洗涤、干燥、灼烧后得到一种固体是氧化铁,氧化铁的质量和铁与铝的混合物质量相等,所以铝的质量相当于氧元素的质量,所以铝的质量分数=
×100%=30%,
故答案为:30%;
(4)根据图象知,次氯酸根离子的物质的量为0.2mol,氯酸根离子的物质的量为0.1mol,所以次氯酸根离子的物质的量与氯酸根离子的物质的量之比为2:1,根据得失电子守恒知,氯气和氢氧化钙的反应方程式为:10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O;
设需要氢氧化钙的质量为x.
10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O
740g 2mol
x 0.1mol
x=37g
故答案为:37g;10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O;
(1)铝离子的电子层数小于硫离子、氯离子的电子层数,电子层数越多,离子半径越大,所以铝离子半径小于氯离子和硫离子半径;电子层数相同的离子,离子半1随着原子序数的增大而减小,所以硫离子半径大于氯离子半径,则为S2->Cl->Al3+,
故答案为:S2->Cl->Al3+;
(2)两种均含A、B、C、F四种元素的化合物分别为硫酸氢钠和亚硫酸氢钠,硫酸氢钠溶液呈强酸性,亚硫酸氢钠是弱酸酸式盐,所以硫酸氢钠和亚硫酸氢钠反应产生硫酸钠、水和二氧化硫,反应的离子方程式为H++HSO3-=SO2↑+H2O,
故答案为:H++HSO3-=SO2↑+H2O;
(3)铁和铝的混合物加入足量稀硫酸后生成硫酸亚铁和硫酸铝,向硫酸亚铁和硫酸铝溶液中加入过量氢氧化钠溶液后生成氢氧化亚铁沉淀和偏铝酸钠溶液,沉淀经洗涤、干燥、灼烧后得到一种固体是氧化铁,氧化铁的质量和铁与铝的混合物质量相等,所以铝的质量相当于氧元素的质量,所以铝的质量分数=
| 16×3 |
| 16×3+56×2 |
故答案为:30%;
(4)根据图象知,次氯酸根离子的物质的量为0.2mol,氯酸根离子的物质的量为0.1mol,所以次氯酸根离子的物质的量与氯酸根离子的物质的量之比为2:1,根据得失电子守恒知,氯气和氢氧化钙的反应方程式为:10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O;
设需要氢氧化钙的质量为x.
10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O
740g 2mol
x 0.1mol
x=37g
故答案为:37g;10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O;
点评:本题主要考查了离子半径比较、离子反应方程式、混合物计算和氧化还原反应的计算,难度较大,元素推断是解题的关键,化学计算是本题的难点,答题时注意充分运用电子守恒分析氧化还原反应的问题.

练习册系列答案
相关题目
1.92g铜粉与一定量浓硝酸反应后铜粉完全溶解,得到气体1.12L(标况),则所消耗硝酸的物质的量( )
| A、0.12mol |
| B、0.11mol |
| C、0.99mol |
| D、0.08mol |
下列离子方程式书写正确的是( )
| A、在FeI2溶液中滴入几滴稀溴水:Fe2++Br2=2Fe3++2Br- |
| B、FeCl3溶液中滴加过量Na2S溶液:2Fe3++S2-═2Fe2++S↓ |
| C、在NaHSO3溶液中滴入Ca(OH)2溶液:HSO3-+OH-=SO32-+H2O |
| D、等物质的量浓度、等体积的NaHSO4溶液与Ba(OH)2溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
下列含氧酸中酸性最强的是( )
| A、H3PO4 |
| B、H3AsO4 |
| C、HNO3 |
| D、HClO |
往NH4HSO4溶液中逐滴加入Ba(OH)2溶液,可能发生的离子方程式正确的是( )
| A、Ba2++SO42-=BaSO4↓ |
| B、NH4++H++2OH-=NH3?H2O+H2O |
| C、NH4++H++SO42-+Ba2++2OH-=BaSO4↓+NH3?H2O+H2O |
| D、NH4++H++2SO42-+2Ba2++2OH-=2BaSO4↓+NH3?H2O+H2O |

 四种短周期元素A、B、C、D的性质或结构信息如下.
四种短周期元素A、B、C、D的性质或结构信息如下.