题目内容
11.粗碳酸锂(含有Na+、K+、Ca2+等杂质离子)制备高纯碳酸锂的工艺流程如图1: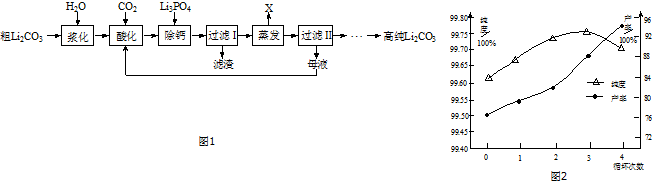
碳酸锂溶解度与温度的关系见下表:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(2)已知Ksp[Ca3(PO4)2]=2.0×10-29,为使溶液中c(Ca2+)≤2×10-5mol•L-1,c(PO43- )的范围
为c(PO43- )≥5×10-8mol•L-1.
(3)蒸发时主要反应的离子方程式为2Li++2HCO3-=Li2CO3↓+CO2↑+H2O.母液循环次数对纯度、产率的影响如图2所示,循环不宜超过3次的主要原因是循环次数增多,溶液中钠离子、钾离子的浓度会增大,会降低产品的纯度.
(4)为了获得高纯Li2CO3,过滤Ⅱ后的操作为将碳酸锂用热水洗涤2~3次、干燥.
分析 粗碳酸锂(含有Na+、K+、Ca2+等杂质离子)制备高纯Li2CO3的工艺流程:粗碳酸锂溶于水再通入二氧化碳生成碳酸氢盐,再加入磷酸锂生成磷酸钙沉淀,过滤而除去钙,对滤液进行蒸发使碳酸氢锂分解生成沉淀Li2CO3,过滤后滤液中含有部分锂离子及钾离子、钠离子等,循环使用,滤渣为碳酸锂,洗涤、干燥后可得纯碳酸锂,
(1)根据碳酸锂在水的溶解度可知,温度越高,碳酸锂溶解度越小,二氧化碳气体在水的溶解度也减小,不利于生成碳酸氢锂,酸化过程中碳酸锂难溶于水,而碳酸氢锂易溶于水,据此判断;
(2)根据Ksp[Ca3(PO4)2]=c3(Ca2+)c2(PO43- ) 可计算出c(PO43- )的范围;
(3)蒸发时碳酸氢锂生成碳酸锂,母液循环次数增多,溶液中钠离子、钾离子的浓度会增大,据此分析;
(4)为了获得高纯Li2CO3,过滤Ⅱ后要将碳酸锂洗涤、干燥.
解答 解:粗碳酸锂(含有Na+、K+、Ca2+等杂质离子)制备高纯Li2CO3的工艺流程:粗碳酸锂溶于水再通入二氧化碳生成碳酸氢盐,再加入磷酸锂生成磷酸钙沉淀,过滤而除去钙,对滤液进行蒸发使碳酸氢锂分解生成沉淀Li2CO3,过滤后滤液中含有部分锂离子及钾离子、钠离子等,循环使用,滤渣为碳酸锂,洗涤、干燥后可得纯碳酸锂,
(1)根据碳酸锂在水的溶解度可知,温度越高,碳酸锂溶解度越小,二氧化碳气体在水的溶解度也减小,减小了反应速率,不利于生成碳酸氢锂,酸化过程中碳酸锂难溶于水,而碳酸氢锂易溶于水,所以判断酸化过程已经结束的明显现象为浆料变成澄清溶液,
故答案为:温度越高,碳酸锂、二氧化碳溶解度都越小,减小了反应速率;浆料变成澄清溶液;
(2)c(Ca2+)≤2×10-5mol•L-1,根据Ksp[Ca3(PO4)2]=c3(Ca2+)c2(PO43- ) 可知,c(PO43- )≥$\sqrt{\frac{Ksp[Ca{\;}_{3}(PO{\;}_{4}){\;}_{2}]}{c{\;}^{3(}Ca{\;}^{2+})}}$=$\sqrt{\frac{2.0×10{\;}^{-29}}{(2×10{\;}^{-5})^{3}}}$=5×10-8mol•L-1,
故答案为:c(PO43- )≥5×10-8mol•L-1;
(3)蒸发时碳酸氢锂生成碳酸锂,反应的离子方程式为2Li++2HCO3-=Li2CO3↓+CO2↑+H2O,母液循环次数增多,溶液中钠离子、钾离子的浓度会增大,会降低产品的纯度,
故答案为:2Li++2HCO3-=Li2CO3↓+CO2↑+H2O;循环次数增多,溶液中钠离子、钾离子的浓度会增大,会降低产品的纯度;
(4)为了获得高纯Li2CO3,过滤Ⅱ后要将碳酸锂用热水洗涤2~3次、干燥,
故答案为:将碳酸锂用热水洗涤2~3次、干燥.
点评 本题以制备高纯Li2CO3的工艺流程为知识背景,考查了影响速率的因素、除杂质、离子方程式等,题目难度中等,侧重于考查学生对题中信息的分析和利用能力.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案| A. | 质子数为7、中子数为8的氮原子:87N | |
| B. | 溴化铵的电子式: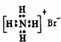 | |
| C. | 乙酸的比例模型: | |
| D. | 间硝基甲苯的结构简式: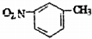 |
| A. | 可能是甲烷和丁烷的混合物 | B. | 可能是甲烷和戊烷的混合物 | ||
| C. | 可能是丁烷和异丁烷的混合物 | D. | 可能是乙烷和丙烷的混合物 |
| A. | 磷酸的摩尔质量与6.02×1023个硫酸分子的质量在数值上相等 | |
| B. | 6.02×1023个氮分子和6.02×l023个氢分子的质量比等于14:1 | |
| C. | 32g氧气所含的原子数目约为1.204×1024 | |
| D. | O2、SO2、SO3三者的质量比为2:4:5时,它们的物质的量之比为2:2:3 |
| A. | 将0.2 mol/L的NH4Al(SO4)2溶液与0.3 mol/L的Ba(OH)2溶液等体积混合:2NH4++Al3++3SO42-+3Ba2++6OH-═Al(OH)3↓+AlO2-+3BaSO4↓+2H2O | |
| B. | 将含有等物质的量溶质的NaHCO3溶液和Ba(OH)2溶液混合:Ba2++HCO${\;}_{3}^{-}$+OH-═BaCO3↓+H2O | |
| C. | 在重铬酸钾溶液中,加酸后溶液变为黄色:Cr2O72-+H2O═2 CrO42-+2H+ | |
| D. | 过量氯水与FeI2溶液作用:2Fe2++2I-+2Cl2═2 Fe3++I2+4Cl- |

| A. | 青蒿酸分子式为:C15H20O2 | |
| B. | 在一定条件,可与乙醇发生酯化反应 | |
| C. | 1 mol青蒿酸可与3 mol H2发生加成反应 | |
| D. | 能使溴水褪色,不能使酸性高锰酸钾溶液褪色 |
| A. | 利用电解的方法可以从海水中获取淡水 | |
| B. | 海水中含有溴元素,只需经过蒸馏等物理变化就可以得到溴单质 | |
| C. | 海水蒸发制海盐的过程只发生了化学变化 | |
| D. | 从海水中提镁时,利用海滩上的贝壳制Ca(OH)2 |
