题目内容
3.已知A、B、C、D、E、F六种元素周期表中的相对位置如图1: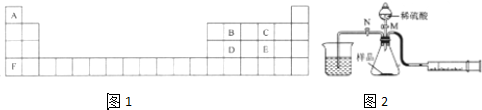
某固体样品由两种常见的盐组成,含A、B、C、F四种元素.现进行如下实验:
(1)在一个质量为ag的蒸发皿中加入一定质量的样品,称得总质量为bg,用酒精灯对其充分加热,冷却后称得其总质量为cg,残留在蒸发皿中的固体是K2CO3(填化学式)
(2)另称取相同质量的样品放入锥形瓶中,用如图2所示的实验装置进行实验
①关闭活塞N,打开活塞M滴入硫酸,至没有气泡产生为止锥形瓶中发生反应的离子方程式CO32-+2H+=CO2↑+H2O、HCO3-+H+=CO2↑+H2O
②为了保证实验成功,所选用针筒的最大刻度值应大于或等于22400($\frac{b-c}{62}$+$\frac{c-a}{138}$)mL(用含a、b、c的代数式表示,设实验在标准状况下进行)
③打开活塞N,把针筒活塞往里推,发现烧杯中F2DC3溶液中有白色沉淀生成,该沉淀的化学式为H2SiO3,根据实验现象可证实B、D、E三种元素的非金属性由强到弱顺序为S>C>Si(填元素符号)
分析 A、B、C、D、E、F分别为H、C、O、Si、S、K,某固体样品由两种常见的盐组成,含A、B、C、F四种元素,
(1)盐加热分解,可知为KHCO3;
(2)①由图可知,碳酸钾、碳酸氢钾均与稀硫酸反应生成二氧化碳气体;
②根据差量法计算出样品中碳酸氢钠的物质的量,再根据碳原子守恒计算出生成二氧化碳的物质的量及体积;
③二氧化碳与硅酸钾反应生成硅酸沉淀,为强酸制取弱酸反应,以此比较非金属性.
解答 解:A、B、C、D、E、F分别为H、C、O、Si、S、K,某固体样品由两种常见的盐组成,含A、B、C、F四种元素,
(1)盐加热分解,可知为KHCO3,发生2KHCO3$\frac{\underline{\;\;△\;\;}}{\;}$K2CO3+CO2↑+H2O,所以残留在蒸发皿中的固体为K2CO3,故答案为:K2CO3;
(2)①由图可知,碳酸钾、碳酸氢钾均与稀硫酸反应生成二氧化碳气体,离子反应为CO32-+2H+=CO2↑+H2O、HCO3-+H+=CO2↑+H2O,
故答案为:CO32-+2H+=CO2↑+H2O、HCO3-+H+=CO2↑+H2O;
②2KHCO3$\frac{\underline{\;\;△\;\;}}{\;}$K2CO3+CO2↑+H2O△m
200 62
m (b-c)
则碳酸氢钾的质量为$\frac{200(b-c)}{62}$g,其物质的量为$\frac{b-c}{62}$mol,
最终含碳酸钾的质量为(c-a)g,其物质的量为$\frac{c-a}{138}$mol,
则标况下生成的二氧化碳的体积为22400mL/mol×($\frac{b-c}{62}$mol+$\frac{c-a}{138}$mol)=22400($\frac{b-c}{62}$+$\frac{c-a}{138}$)mL,
故答案为:22400($\frac{b-c}{62}$+$\frac{c-a}{138}$);
③二氧化碳与硅酸钾反应生成硅酸沉淀,沉淀的化学式为H2SiO3,为强酸制取弱酸反应,结合硫酸与碳酸氢钾反应生成二氧化碳,可知酸性为硫酸>碳酸>硅酸,则非金属性为S>C>Si,故答案为:H2SiO3;S>C>Si.
点评 本题考查无机物的推断及计算,为高频考点,把握元素化合物知识、差量法计算、原子守恒等为解答的关键,侧重分析与应用能力的考查,注意元素周期律及元素化合物知识的应用,题目难度不大.

| A. | 石油的分馏是物理变化,得到的各个馏分都是纯净物 | |
| B. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | |
| C. | CH3CH218OH和CH3COOH反应生成的水的相对分子质量为18 | |
| D. | 石油裂解可以得到乙烯,煤干馏得到的煤焦油中可以提取苯,乙烯和苯使溴水褪色的原理相同 |
| A. | 氯化氢 | B. | 氢氧化钠 | C. | 酒精 | D. | 氯化钠 |
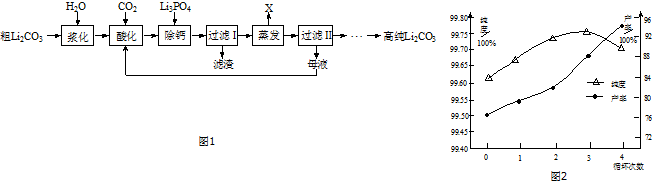
碳酸锂溶解度与温度的关系见下表:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(2)已知Ksp[Ca3(PO4)2]=2.0×10-29,为使溶液中c(Ca2+)≤2×10-5mol•L-1,c(PO43- )的范围
为c(PO43- )≥5×10-8mol•L-1.
(3)蒸发时主要反应的离子方程式为2Li++2HCO3-=Li2CO3↓+CO2↑+H2O.母液循环次数对纯度、产率的影响如图2所示,循环不宜超过3次的主要原因是循环次数增多,溶液中钠离子、钾离子的浓度会增大,会降低产品的纯度.
(4)为了获得高纯Li2CO3,过滤Ⅱ后的操作为将碳酸锂用热水洗涤2~3次、干燥.
| A. | 80% | B. | 60% | C. | 40% | D. | 33.3% |
| A. |  2-甲基丁烷 2-甲基丁烷 | B. | (CH3)2CHCH2CH2OH 1-戊醇 | ||
| C. |  1,4-二甲苯 1,4-二甲苯 | D. |  2-甲基丙烯 2-甲基丙烯 |
| A. | MgCl2 | B. | H2O | C. | Ne | D. | NaOH |
| A. | 丙烷的填充模型是 | B. | C2H4与C3H6一定互为同系物 | ||
| C. |  属 于芳香烃 属 于芳香烃 | D. |  和 和 互为同分异构体 互为同分异构体 |
| A. | 用CH3COOH溶解CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 氯化铝溶液中滴加过量氨水Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | FeCl2溶液中通入Cl2 Fe2++Cl2═Fe3++2Cl- | |
| D. | 过量二氧化碳通入偏铝酸钠溶液中CO2+2H2O+AlO2-═Al(OH)3↓+HCO3- |