题目内容
某温度下,把1mol的A2(单质)气体和1mol的B2(单质)气体,放入容积为1L的容器内,使其反应生成气体C,2min后测得容器中A2的浓度为0.4mol/L,B2的浓度为0.8mol/L,C的浓度为0.4mol/L.则此反应的化学方程式为 .
考点:化学反应速率和化学计量数的关系,化学平衡的计算
专题:化学平衡专题
分析:计算各物质的浓度变化量,利用浓度变化量之比等于化学计量数之比确定各物质的系数,再利用原子守恒确定生成物C组成,据此书写.
解答:
解:开始A2和B2两种气体的浓度均为1mol/L,在密闭容器内反应生成气体C,2min后,测得:c(A2)=0.4mol/L,c(B2)=0.8mol/L,c(C)=0.4mol/L,
故△c(A2)=1mol/L-0.4mol/L=0.6mol/L,
△c(B2)=1mol/L-0.8mol/L=0.2mol/L,
△c(C)=0.4mol/L,
故A2、B2、C的化学计量数之比为0.4mol/L:0.6mol/L:0.4mol/L=2:3:2,
故该反应可表示为2A2+3B2?2C,根据原子守恒可知,C为A2B3,即表达式为2A2+3B2?2A2B3,
答:则此反应的化学方程式为2A2+3B2?2A2B3.
故△c(A2)=1mol/L-0.4mol/L=0.6mol/L,
△c(B2)=1mol/L-0.8mol/L=0.2mol/L,
△c(C)=0.4mol/L,
故A2、B2、C的化学计量数之比为0.4mol/L:0.6mol/L:0.4mol/L=2:3:2,
故该反应可表示为2A2+3B2?2C,根据原子守恒可知,C为A2B3,即表达式为2A2+3B2?2A2B3,
答:则此反应的化学方程式为2A2+3B2?2A2B3.
点评:本题考查化学平衡的有关计算,难度不大,确定化学计量数是解题的关键,注意利用原子守恒的确定C的表达式.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | ||||
B、往硫酸铝铵NH4Al(SO4)2溶液中滴加Ba(OH)2溶液并加热,刚好使NH4+全部转化为NH3:NH4++Al3++2SO42-+2Ba2++4OH-
| ||||
C、用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-
| ||||
| D、FeSO4溶液与稀硫酸、双氧水混合:Fe2++H2O2+2H+═Fe3++2H2O |
下列叙述正确的是( )
| A、在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 |
| B、用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1mol NaOH |
| C、用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 |
| D、镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
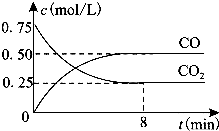 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)=FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)=FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.