题目内容
3.实验是进行化学研究的重要手段之一.请回答下列问题:(1)下列实验操作,错误的是bc(填写序号).
a.用纸槽往试管里装粉末状药品时,试管应先横放再直立
b.称取氢氧化钠固体时,应将氢氧化钠固体直接放在左边托盘内,右边托盘放砝码
c.试管、烧杯、量筒、集气瓶都不能用酒精灯直接加热
d.闻气体气味时,应取一瓶盛满气体的集气瓶,稍打开玻璃片,用手轻轻扇地在瓶口扇动,使极少量的气体飘进鼻孔,闻气味
(2)实验室需要一定物质的量浓度的溶液.请回答下列问题:
①在如图所示仪器中,配制450mL 1mol•L-1硫酸溶液肯定不需要的是C(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器有烧杯、玻璃棒
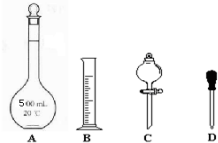
②在容量瓶的使用方法中,下列操作正确的是abd(填写序号).
a.使用容量瓶前检验是否漏水
b.容量瓶用水洗净后,再用待配溶液洗涤
c.若配制硫酸溶液时,用量筒量取浓硫酸后用玻璃棒引流注入容量瓶中,然后加蒸馏水.
d.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀.
③实验室需要配制450mL 1mol•L-1 NaOH溶液,其实验步骤如下:
a.计算应称取氢氧化钠固体的质量为20.0g;b.称量氢氧化钠固体;c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶;d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却;e.盖好瓶塞,反复上下颠倒,摇匀;f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切.
上述步骤的正确操作顺序为a、bdcf、e(用序号表示).
(3)将4.48L(标准状况)氨气通入水中得到0.05L溶液,所得溶液的物质的量浓度是4mol/L.
分析 (1)a.粉状药品不能沾在试管内壁上;
b.氢氧化钠具有强腐蚀性,且溶液潮解变质,不能直接放在纸片上称量;
c.实验室中,能够直接加热的仪器有:试管、燃烧匙、蒸发皿和坩埚等;需要垫石棉网的是:烧杯、烧瓶、锥形瓶等.
不能加热的仪器有:漏斗、量筒、集气瓶等,据此进行判断;
d.闻气体气味时应尽可能让极少量气体飘进鼻孔,防止中毒;
(2)①配溶液,需要溶解、转移、定容等操作;
②容量瓶洗净后,不需要润洗,只能在室温下配制一定浓度的溶液;
③根据m=cVM计算氢氧化钠的质量,注意溶液的体积为500mL而不是450mL,然后根据配制过程对各操作进行排序;
(3)结合n=$\frac{V}{Vm}$、c=$\frac{n}{V}$计算.
解答 解:(1)a.粉末状固体一般采用药匙或纸槽取用,试管应先横放再直立,故a正确;
b.称量NaOH固体时,不能将NaOH直接放在托盘上的纸上,因为氢氧化钠具有强腐蚀性、容易潮解变质,应该放在烧杯中快速称量,故b错误;
c.试管可以直接加热、烧杯需要垫上石棉网加热,而量筒、集气瓶不能用酒精灯直接加热,故c错误;
d.闻气体气味时,应取一瓶盛满气体的集气瓶,稍打开玻璃片,用手轻轻地在瓶口扇动,使极少量的气体飘进鼻孔,闻气味,操作正确,故d正确;
故答案为:bc;
(2)①用500mL容量瓶配制溶液,用胶头滴管定容,量筒量液体,不需要分液漏斗;还需要用到的仪器有:溶解或稀释药品的烧杯、搅拌或引流用的玻璃棒,
故答案为:C;烧杯、玻璃棒;
②根据容量瓶使用时的注意事项:使用容量瓶前检验是否漏水、容量瓶用水洗净后,不能用待配溶液洗涤、不能盛放热溶液、不能作为稀释仪器等,定容后摇匀,abd操作合理,
故答案为:abd;
③配制450mL 1mol•L-1 NaOH溶液,m=cVM=1mol/L×0.5L×40g/mol=20.0g;配制500mL 0.1mol•L-1标准氢氧化钠溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,所以正确的操作顺序为:abdcfe,
故答案为:20.0;bdcf;
(3)将4.48L(标准状况)氨气通入水中得到0.05L溶液,所得溶液的物质的量浓度是$\frac{\frac{4.48L}{22.4L/mol}}{0.05L}$=4mol/L,故答案为:4mol/L.
点评 本题考查化学实验方案的评价,为高频考点,把握实验基本操作及实验技能、溶液配制、物质的量浓度的计算为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

 阅读快车系列答案
阅读快车系列答案①有化学键破坏的变化一定属于化学变化
②发生了颜色变化的一定是化学变化
③电解质溶液导电一定发生化学变化
④用糯米、酒曲和水制成甜酒酿,一定是化学变化
⑤用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐不涉及化学变化.
| A. | ①③⑤ | B. | ②③④ | C. | ③④⑤ | D. | 全部 |
| A. | 0.1s | B. | 2.5s | C. | 5s | D. | 10s |
| 物质 | 熔点(℃) | 沸点(℃) | 密度 (g•cm-3) | 二者溶解性关系 |
| 甲 | -98 | 57.5 | 1.93 | 互不相溶 |
| 乙 | -84 | 77 | 0.90 |
| A. | 蒸馏 | B. | 蒸发 | C. | 过滤 | D. | 分液 |
| A. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O (l)△H=+1135.7kJ•mol-1 | |
| B. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(l)△H=-1135.7kJ•mol-1 | |
| C. | N2H4(g)+NO2(g)═N2(g)+2H2O(g)△H=+1135.7kJ•mol-1 | |
| D. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1135.7kJ•mol-1 |
| A. | 电解饱和食盐水或熔融氯化钠时,阳极的电极反应式均为2Cl--2e-═Cl2↑ | |
| B. | 钢铁发生吸氧腐蚀和析氢腐蚀的负极反应式均为Fe-2e-═Fe2+ | |
| C. | 精炼铜和电镀铜时,与电源负极相连的电极反应式均为Cu2++2e-═Cu | |
| D. | 酸性介质或碱性介质的氢氧燃料电池的正极反应式均为O2+2H2O+4e-═4OH- |