题目内容
13.已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系: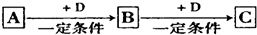
(1)若D是具有氧化性的单质,A元素属于短周期主族金属元素,则C的化学式为Na2O2.
(2)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为O=C=O.
(3)若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根离子外还存在的阴离子为AlO2- (填化学式).
(4)若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子.则B转化为C的离子方程式为CO2+CO32-+H2O=2HCO3-.
(5)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明)加入少量铁,防止Fe2+被氧化为Fe3+,2Fe3++Fe═3Fe2+.
(6)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体.则A转化为B反应的化学程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
分析 (1)D是具有氧化性的单质,A元素属于短周期主族金属元素,根据反应关系可知应为Na$\stackrel{O_{2}}{→}$Na2O$\stackrel{O_{2}}{→}$Na2O2的反应;
(2)若A、B、C均为氧化物,D是一种黑色固态非金属单质,发生CuO$\stackrel{C}{→}$CO2$\stackrel{C}{→}$CO;
(3)若D为氯碱工业的主要产品,B具有两性,则判断转化关系为AlCl3$\stackrel{NaOH}{→}$Al(OH)3$\stackrel{NaOH}{→}$NaAlO2;
(4)若D是一种常见的温室气体推断为CO2,A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子结合离子结构推断A为NaOH$\stackrel{CO_{2}}{→}$Na2CO3$\stackrel{CO_{2}}{→}$NaHCO3;
(5)若D是金属,C溶液在贮存时应加入少量D,推断A为Cl2$\stackrel{Fe}{→}$FeCl3$\stackrel{Fe}{→}$FeCl2;
(6)若A能使湿润的红色石蕊试纸变蓝,可知A为NH3,红棕色气体C为NO2,可判断D为O2,B为NO.
解答 解:(1)D是具有氧化性的单质,A元素属于短周期主族金属元素,根据反应关系可知应为Na$\stackrel{O_{2}}{→}$Na2O$\stackrel{O_{2}}{→}$Na2O2的反应,则C的化学式为Na2O2,
故答案为:Na2O2;
(2)若A、B、C均为氧化物,D是一种黑色固态非金属单质,发生CuO$\stackrel{C}{→}$CO2$\stackrel{C}{→}$CO,则B的结构式为O=C=O,故答案为:O=C=O;
(3)若D为氯碱工业的主要产品,B具有两性,则判断转化关系为AlCl3$\stackrel{NaOH}{→}$Al(OH)3$\stackrel{NaOH}{→}$NaAlO2,则C溶液中除氢氧根离子外还存在的阴离子为AlO2-,
故答案为:AlO2-;
(4)若D是一种常见的温室气体推断为CO2,A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子结合离子结构推断A为NaOH$\stackrel{CO_{2}}{→}$Na2CO3$\stackrel{CO_{2}}{→}$NaHCO3,B转化为C的离子方程式为:CO2+CO32-+H2O=2HCO3-,故答案为:CO2+CO32-+H2O=2HCO3-;
(5)若D是金属,C溶液在贮存时应加入少量D,推断A为Cl2$\stackrel{Fe}{→}$FeCl3$\stackrel{Fe}{→}$FeCl2,C溶液在贮存时应加入少量D,其理由是:加入少量铁,防止Fe2+被氧化为Fe3+,2Fe3++Fe═3Fe2+,故答案为:加入少量铁,防止Fe2+被氧化为Fe3+,2Fe3++Fe═3Fe2+;
(6)A能使湿润的红色石蕊试纸变蓝,可知A为NH3,红棕色气体C为NO2,可判断D为O2,B为NO,A转化为B反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应及相互转化为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.

| A. | 按系统命名法,化合物 的名称是2,5,5-三甲基-3-乙基庚烷 的名称是2,5,5-三甲基-3-乙基庚烷 | |
| B. | 将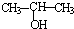 与NaOH的醇溶液共热可制备CH3-CH═CH2 与NaOH的醇溶液共热可制备CH3-CH═CH2 | |
| C. | 向柠檬醛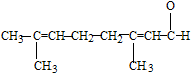 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 | |
| D. | 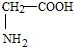 、 、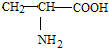 、 、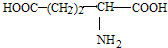 三种氨基酸脱水,最多可生成6种二肽 三种氨基酸脱水,最多可生成6种二肽 |
| A. | 三种元素的氢化物中只有极性键没有非极性键 | |
| B. | Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 | |
| C. | 三种元素的气态最简单氢化物中Z的氢化物最稳定 | |
| D. | 原子半径由大到小的顺序为Z>Y>X |
| 阳离子 | K+ Ba2+ Fe2+ Al3+ Fe3+ Mg2+ |
| 阴离子 | OH- HCO3- CO32- Cl- NO3- SO42- |
(1)溶液中一定不(填“一定”、“一定不”或“可能”)含有HCO3-或CO32-,理由是HCO3-与CO32-均可与盐酸反应生成二氧化碳,造成阴离子种类有所变化.
(2)原溶液中所含的阴离子为Cl-、NO3-、SO42-,阳离子为Fe2+、Mg2+.
(3)向原溶液中加入足量的盐酸,有无色气体生成的离子反应方程式为3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥灼烧至恒重,得到固体质量为120g.
| A. | 9 min | B. | 27 min | C. | 13.5 min | D. | 3 min |
| A. |  和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物 ,该反应符合绿色化学原则 ,该反应符合绿色化学原则 | |
| B. | 正丁烷的二氯代物有5种(不考虑立体异构) | |
| C. | 乙醇在铜催化下加热可脱氢生成乙醛,该反应属于氧化反应 | |
| D. | 淀粉、纤维素、麦芽糖均属于糖类,在一定条件下都可以水解得到葡萄糖 |
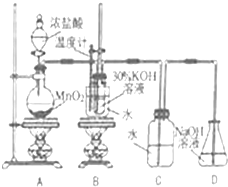 某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.
某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验. .
.