题目内容
15.我国卫星发射所用的长征2号火箭的主要燃料是偏二甲肼(C2H8N2),氧化剂是NO2,燃烧产物只有N2、CO2和H2O.有的国家用肼(N2H4)作为火箭发动机的燃料.NO2为氧化剂,反应生成N2和水蒸气.已知:N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ•mol-1;N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ•mol-1.下列关于肼和NO2反应的热化学方程式中正确的是( )| A. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O (l)△H=+1135.7kJ•mol-1 | |
| B. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(l)△H=-1135.7kJ•mol-1 | |
| C. | N2H4(g)+NO2(g)═N2(g)+2H2O(g)△H=+1135.7kJ•mol-1 | |
| D. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1135.7kJ•mol-1 |
分析 依据热化学方程式和盖斯定律计算得到所需热化学方程式,依据盖斯定律已知:①N2(g)+2O2(g)═2NO2(g),△H=+67.7KJ•mol-1;②N2H4(g)+O2(g)═N2(g)+2H2O (g),△H=-534KJ•mol-1,将方程式2×②-①得,由此分析解答.
解答 解:已知:①N2(g)+2O2(g)═2NO2(g),△H=+67.7KJ•mol-1;
②N2H4(g)+O2(g)═N2(g)+2H2O (g),△H=-534KJ•mol-1
将方程式2×②-①得2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=2×(-534KJ•mol-1)-(+67.7KJ•mol-1)=-1135.7kJ•mol-1,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ•mol-1.
故选D.
点评 本题考查反应热的计算,掌握盖斯定律及其计算方法是关键,题目较简单.

练习册系列答案
相关题目
5.下列说法错误的是( )
| A. |  和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物 ,该反应符合绿色化学原则 ,该反应符合绿色化学原则 | |
| B. | 正丁烷的二氯代物有5种(不考虑立体异构) | |
| C. | 乙醇在铜催化下加热可脱氢生成乙醛,该反应属于氧化反应 | |
| D. | 淀粉、纤维素、麦芽糖均属于糖类,在一定条件下都可以水解得到葡萄糖 |
10.把等物质的量的CuSO4、FeCl3和锌粉置于足量的水中,充分反应,反应后的溶液中大量存在的金属阳离子是( )
| A. | Cu2+、Fe3+、Fe2+、Zn2+ | B. | Fe3+、Fe2+、Zn2+ | ||
| C. | Cu2+、Fe3+、Zn2+ | D. | Cu2+、Fe2+、Zn2+ |
20.下列化学用语表示不正确的是( )
| A. | 乙醛的结构简式:CH3COH | |
| B. | 乙烯的比例模型: | |
| C. | S2-的结构示意图: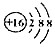 | |
| D. | 含中子数为10的氧元素的一种核素${\;}_{8}^{18}$O |
7.下列有关NA叙述正确的是( )
| A. | 标准状况下,1molSO3的气体体积为22.4L | |
| B. | 1mol铁粉与过量Cl2反应时,转移电子数为2NA | |
| C. | 含有2NA个氧原子的D2O质量为40g | |
| D. | 16gO2分子中含有的氧原子数为0.5NA |