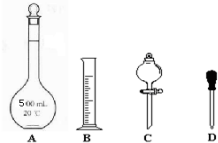
题目内容
11.M(SO2)是64g/mol,0.25mol O2的标准状况下的体积约为5.6L.分析 相对分子质量与摩尔质量的数值相同,单位不同;结合V=nVm计算.
解答 解:M(SO2)是64g/mol,0.25mol O2的标准状况下的体积约为0.25mol×22.4L/mol=5.6L,
故答案为:64g/mol;5.6L.
点评 本题考查物质的量的计算,为高频考点,把握体积、物质的量为解答的关键,侧重分析与计算能力的考查,注意Vm及状况的关系,题目难度不大.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
1.某种溶液仅含下表离子中的5种(不考虑水的电离与离子水解),且各种离子的物质的量均为1mol.
若向原溶液中加入足量的盐酸,有无色气体生成.经分析反应后溶液中阴离子的种类没有变化.
(1)溶液中一定不(填“一定”、“一定不”或“可能”)含有HCO3-或CO32-,理由是HCO3-与CO32-均可与盐酸反应生成二氧化碳,造成阴离子种类有所变化.
(2)原溶液中所含的阴离子为Cl-、NO3-、SO42-,阳离子为Fe2+、Mg2+.
(3)向原溶液中加入足量的盐酸,有无色气体生成的离子反应方程式为3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥灼烧至恒重,得到固体质量为120g.
| 阳离子 | K+ Ba2+ Fe2+ Al3+ Fe3+ Mg2+ |
| 阴离子 | OH- HCO3- CO32- Cl- NO3- SO42- |
(1)溶液中一定不(填“一定”、“一定不”或“可能”)含有HCO3-或CO32-,理由是HCO3-与CO32-均可与盐酸反应生成二氧化碳,造成阴离子种类有所变化.
(2)原溶液中所含的阴离子为Cl-、NO3-、SO42-,阳离子为Fe2+、Mg2+.
(3)向原溶液中加入足量的盐酸,有无色气体生成的离子反应方程式为3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥灼烧至恒重,得到固体质量为120g.
19.下列反应的离子方程式正确的是( )
| A. | 硫酸铝溶液和过量的NaOH溶液反应:Al3++4OH-=AlO2-+2H2O | |
| B. | Mg(OH)2与盐酸的反应:H++OH-═H2O | |
| C. | 硫化亚铁(FeS)与盐酸反应:S2-+2H+═H2S↑ | |
| D. | 钠和冷水反应:Na+2H2O═Na++H2↑+2OH- |
20.下列化学用语表示不正确的是( )
| A. | 乙醛的结构简式:CH3COH | |
| B. | 乙烯的比例模型: | |
| C. | S2-的结构示意图: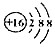 | |
| D. | 含中子数为10的氧元素的一种核素${\;}_{8}^{18}$O |
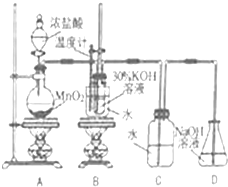 某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.
某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.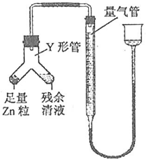 .
.