题目内容
15.黄铁矿因其浅黄铜色和明亮的金属光泽,常被误认为是黄金,故又称为“愚人金”.某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究.[实验一]:测定硫元素的含量
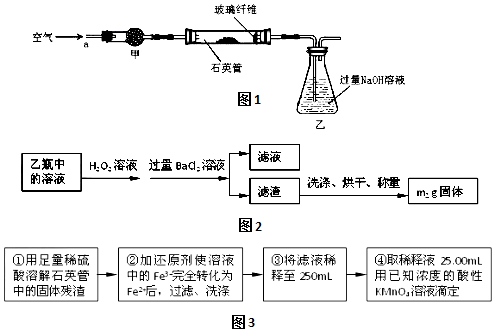
I.将m1 g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全得到红棕色固体和一种刺激性气味的气体.
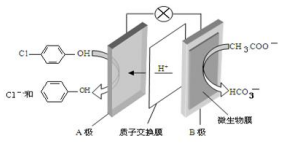
Ⅱ.反应结束后,将乙瓶中的溶液进行如图2处理:
问题讨论:
(1)写出石英管中发生反应的化学方程式为:4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
(2)I中,干燥管甲内所盛试剂是碱石灰(或氢氧化钠固体或氧化钙固体),有同学提出该实验装置存在安全隐患,请用简洁的文字说明:装置乙易发生倒吸.
(3)该黄铁矿石中硫元素的质量分数为$\frac{32{m}_{2}}{233{m}_{1}}$×100%.
[实验二]:设计图3实验方案测定铁元素的含量
问题讨论:
(4)②中,若选用铁粉作还原剂,会使测量结果偏高(填“不影响”、“偏高”或“偏低”).
(5)③中,需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还有250mL容量瓶.
(6)④中发生反应的离子方程式为5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O.
分析 (1)石英管中发生反应是高温下FeS2被氧气氧化成二氧化硫和三氧化二铁;
(2)甲中使用固体干燥剂,用于除掉空气中的水分,所以选用碱石灰;装置乙易发生倒吸现象;
(3)根据硫原子守恒计算硫铁矿中硫的质量,从而计算其质量分数;
(4)铁和铁离子反应生成的亚铁离子物质的量增大;若将稀释液久置,溶液中的亚铁离子部分被氧化成铁离子;
(5)根据一定物质的量浓度溶液的配制中需使用的仪器完成;
(6)酸性高锰酸钾溶液氧化亚铁离子生成铁离子.
解答 解:(1)高温下,FeS2被氧气氧化成二氧化硫和氧化铁,根据化合价升降相等配平:二硫化亚铁当做整体,化合价总共升高了(1×1+5×2)=11价,氧气化合价降低4价,所以氧气前面配11,二硫化亚铁前面配4,配平后的化学方程式为:4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,
故答案为:4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+8SO2;
(2)由于甲装置需要使用固体干燥剂,用于除掉空气中的水分,可以选用碱石灰(或氢氧化钠固体或氧化钙固体),该实验装置存在安全隐患是乙装置中液体易到吸入玻璃管,
故答案为:碱石灰(或氢氧化钠固体或氧化钙固体);装置乙易发生倒吸;
(3)最终所得沉淀是硫酸钡,根据硫原子守恒得硫的质量,设硫的质量为x,
S-----BaSO4
32g 233g
x m2g
x=$\frac{32{m}_{2}}{233}$g
质量分数=$\frac{32{m}_{2}}{233{m}_{1}}$×100%,
故答案为:$\frac{32{m}_{2}}{233{m}_{1}}$×100%;
(4)铁和铁离子反应生成的亚铁离子物质的量增大,用高锰酸钾物质的量增大,测定结果偏高,故答案为:偏高;
(5)一定物质的量浓度溶液的配制中,除了烧杯、玻璃棒、胶头滴管外,还需要250mL容量瓶,故答案为:250mL容量瓶;
(6)④中发生反应为高锰酸钾溶液氧化亚铁离子生成铁离子,氧化还原反应离子方程式为:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O,
故答案为:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O.
点评 本题考查物质成分和含量的测定,涉及仪器选用、误差分析、质量分数计算等知识,具有较强的综合性,解题时注意从质量守恒的角度分析,题目难度中等.

| A. | 碱性氧化物 | B. | 酸性氧化物 | C. | 碱 | D. | 盐 |
| A. | 常温下,C(s)+H2O(g)?CO(g)+H2(g)不能自发进行,则该反应的△H<0 | |
| B. | 合成氨反应中使用高效催化剂可提高原料转化率 | |
| C. | 电解冶炼铝时需定期更换阳极的石墨电极 | |
| D. | 25℃时,向0.1 mol•L-1 CH3COOH溶液中加水稀释,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 |
| A. | 56g铁片与足量浓H2SO4在加热的条件下可生成1.5NA个SO2分子 | |
| B. | 标准状况下20g D2O分子中所含中子数为10NA | |
| C. | 常温下,将0.1NA个氯化氢分子溶于1L水中,得到0.1mol/L的盐酸 | |
| D. | 2.8g乙烯和2.8g聚乙烯中含碳原子数均为0.2NA |
 现在污水治理越来越引起人们重视,可以通过
现在污水治理越来越引起人们重视,可以通过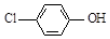 膜电池除去废水中的乙酸钠和对氯苯酚( ),其原理如图所示,下列说法正确的是.
膜电池除去废水中的乙酸钠和对氯苯酚( ),其原理如图所示,下列说法正确的是.| A. | 电流方向从B极沿导线经小灯泡流向A极 | |
| B. | A极的电极反应式为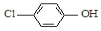 +e-═Cl-+ +e-═Cl-+ | |
| C. | 当外电路中有0.2mole-转移时,通过质子交换膜的H+的个数为0.1NA | |
| D. | B极为电池的正极,发生还原反应 |
| A. | Fe不能与水蒸气发生化学反应 | |
| B. | 白色Fe(OH)2在空气中放置最终变成灰绿色 | |
| C. | 铝可以与氢氧化钠溶液发生反应:2Al+2NaOH+2H2O═2NaAlO2+3H2↑ | |
| D. | 氯化铁溶液不能与铜单质发生反应 |
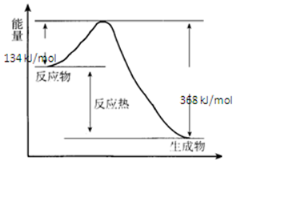 (1)下列反应中,属于吸热反应的是④⑤⑦.
(1)下列反应中,属于吸热反应的是④⑤⑦. 有关物质的转化关系如图1所示.A是黑色非金属单质,C、E、F均为氧化物,E、F常温下呈气态,且E能使品红褪色,G是一种常见的无色液体,I是一种难溶于水的白色胶状沉淀,能溶于B溶液.请回答下列问题:
有关物质的转化关系如图1所示.A是黑色非金属单质,C、E、F均为氧化物,E、F常温下呈气态,且E能使品红褪色,G是一种常见的无色液体,I是一种难溶于水的白色胶状沉淀,能溶于B溶液.请回答下列问题: .
.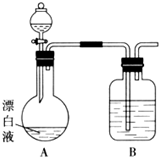 实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.
实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.