题目内容
15.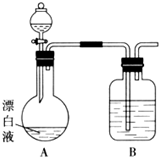 实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.
实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.(1)小组同学依据漂白液具有漂白消毒的性质推测,漂白液中ClO-具有氧化性.实验如下:
Ⅰ.用pH试纸检验,漂白液pH>7,饱和KAl(SO4)2溶液pH<7.
Ⅱ.取10mL漂白液,依次加入Na2SO3溶液和BaCl2溶液,有白色沉淀生成,经检验白色沉淀不溶于盐酸.
Ⅲ.另取10mL,漂白液,加入品红溶液,溶液红色逐渐变浅,一段时间后褪为无色.
Ⅳ.再取10mL漂白液,加入品红溶液,加入少量稀硫酸酸化后,溶液红色立即变为无色.
①漂白液pH大于7的原因是(用离子方程式表示)ClO-+H2O?HClO+OH-.
②由实验Ⅱ得出ClO-具有氧化性,写出相应的离子方程式ClO-+SO32-=Cl-+SO42-、Ba2++SO42-=BaSO4↓或Ba2++ClO-+SO32-=BaSO4↓+Cl-.
③对比实验Ⅲ和Ⅳ说明ClO-氧化性与溶液酸碱性的关系是ClO-的氧化性随氢离子浓度增大而增大.
(2)小组同学依据(1)中的实验,提出:漂白液在酸性溶液中有Cl2生成.
用图所示的装置继续实验,探究漂白液在酸性溶液中是否能反应生成Cl2.
①装置B的作用是吸收氯气防止污染空气;盛放的药品是NaOH溶液.
②若打开分液漏斗活塞向烧瓶中加入硫酸,不久烧瓶中有黄绿色气体产生.A中反应的离子方程式ClO-+Cl-+2H+=Cl2↑+H2O.
③若打开分液漏斗活塞向烧瓶中加入饱和KAl(SO4)2溶液,观察到产生大量的白色胶状沉淀,同时有黄绿色气体产生.A中加KAl(SO4)2溶液反应的离子方程式是3ClO-+Al3++3H2O=3HClO+Al(OH)3↓.
(3)上述实验说明漂白液与酸性溶液混合会产生Cl2.若取10mL漂白液与足量BaCl2溶液混合后,不断通入SO2至过量,在实验过程中可能的实验现象是产生白色沉淀.
分析 (1)①NaClO为强碱弱酸盐,水解显碱性;
②Ⅱ中由白色沉淀生成,经检验白色沉淀不溶于盐酸,可知白色沉淀为BaSO4,发生氧化还原反应;
③Ⅳ中加入少量稀硫酸酸化后,溶液红色立即变为无色,生成HClO,氧化性增强;
(2)①漂白液在酸性溶液中有Cl2生成,则分液漏斗中为酸,B中盛放NaOH溶液吸收氯气,以此来解答;
②次氯酸钙和氯化钙加入硫酸发生氧化还原反应生成氯气硫酸钙和水;
③烧瓶中加入饱和KAl(SO4)2溶液,次氯酸根离子水解显碱性,铝离子水解显酸性,混合后水解相互促进,产生大量的白色胶状沉淀和次氯酸;
(3)过量的SO2气体通入漂白液中,次氯酸具有氧化性氧化二氧化硫为硫酸,发生氧化还原反应,结合钡离子生成硫酸钡白色沉淀.
解答 解:(1)①NaClO为强碱弱酸盐,水解显碱性,水解离子反应为ClO-+H2O?HClO+OH-,
故答案为:ClO-+H2O?HClO+OH-;
②Ⅱ中由白色沉淀生成,经检验白色沉淀不溶于盐酸,可知白色沉淀为BaSO4,发生氧化还原反应,反应的离子方程式为:ClO-+SO32-=Cl-+SO42-、Ba2++SO42-=BaSO4↓或Ba2++ClO-+SO32-=BaSO4↓+Cl-;,
故答案为:ClO-+SO32-=Cl-+SO42-、Ba2++SO42-=BaSO4↓或Ba2++ClO-+SO32-=BaSO4↓+Cl-;
③Ⅳ中加入少量稀硫酸酸化后,溶液红色立即变为无色,生成HClO,氧化性增强,
由上述两个实验对比可知,加入酸,反应速率加快,则ClO-的氧化性随氢离子浓度增大而增大,
故答案为:ClO-的氧化性随氢离子浓度增大而增大;
(2)①漂白液在酸性溶液中有Cl2生成,则分液漏斗中为酸,B中盛放NaOH溶液,其作用为吸收氯气、防止污染空气,装置B中溶液为氢氧化钠溶液用来吸收氯气,
故答案为:吸收氯气防止污染空气; NaOH溶液;
②次氯酸钙和氯化钙加入硫酸发生氧化还原反应生成氯气硫酸钙和水,反应的离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O,
故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;
③烧瓶中加入饱和KAl(SO4)2溶液,次氯酸根离子水解显碱性,铝离子水解显酸性,混合后水解相互促进,产生大量的白色胶状沉淀和次氯酸,反应的离子方程式为:3ClO-+Al3++3H2O=3HClO+Al(OH)3↓,将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生为氯气,充分反应后集气瓶中收集到一种无色无味的气体为氧气.依据氧化还原反应电子守恒写出化学方程式配平得到:4HClO$\frac{\underline{\;光照\;}}{\;}$2H2O+2Cl2↑+O2↑,
故答案为:3ClO-+Al3++3H2O=3HClO+Al(OH)3↓;
(3)过量的SO2气体通入漂白液中,次氯酸具有氧化性氧化二氧化硫为硫酸,发生氧化还原反应,结合钡离子生成硫酸钡白色沉淀,
故答案为:生成白色沉淀.
点评 本题考查了次氯酸盐的性质分析判断,主要是氧化性和产物分析,离子方程式书写方法,掌握基础是解题关键,题目难度中等.

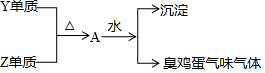 X、Y、Z、W处于同一周期的四种短周期元素,其原子序数逐渐增大,X、W分别是本周期原子半径最大和最小的主族元素,Y单质在工业上用电解其氧化物的方法制取,Y、Z形成的单质有如下转化关系图.下列说法正确的是( )
X、Y、Z、W处于同一周期的四种短周期元素,其原子序数逐渐增大,X、W分别是本周期原子半径最大和最小的主族元素,Y单质在工业上用电解其氧化物的方法制取,Y、Z形成的单质有如下转化关系图.下列说法正确的是( )| A. | Y、Z形成的化合物可利用离子反应制备 | |
| B. | X、Z形成的化合物可能含共价键 | |
| C. | 化合物XW能促进水的电离 | |
| D. | Y元素只能存在于阳离子中 |
| A. | SO2是大气污染物,但葡萄酒中都含有一定量的SO2,SO2既可杀菌又可用来保鲜 | |
| B. | 绿色化学的核心是在化学合成中将原子充分利用,从源头上减少或消除污染 | |
| C. | 茂密树林中的道道光柱,既是一种自然现象又是光学现象,与胶体知识也有关系 | |
| D. | 研发使用高效催化剂,可提高反应中原料的转化率 |
①SiO2→Na2SiO3 ②S→SO3 ③NH3→N2
④CuO→Cu(OH)2 ⑤Cl2→NaClO ⑥SO2→H2SO4.
| A. | ①②⑥ | B. | ②③④ | C. | ②④⑥ | D. | ②④ |
| A. | 最终得到沉淀的质量大于$\frac{37m}{28}$g | |
| B. | 该饱和溶液质量百分比浓度为$\frac{s}{100+s}$% | |
| C. | 最终所得溶液c(OH-)不变 | |
| D. | 该饱和溶液中溶质物质的量浓度为$\frac{1000ρs}{74(100+s)}$mol/L |
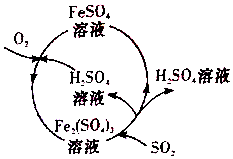 含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )
含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )| A. | 该过程中可得到化工产品H2SO4 | |
| B. | 该工艺流程是除去煤燃烧时产生的SO2 | |
| C. | 该过程中化合价发生改变的元素为Fe和S | |
| D. | 图中涉及到的反应之一为Fe2(SO4)3+SO2+2H2O═2FeSO4+2H2SO4 |
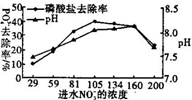 某文献报道可将ASBBR(一种生物膜反应器)用在有PO43-存在的环境中除磷,有一类微生物可在其中将PO43-还原为PH3,这项研究为解决含磷污染物的净化问题提供了新思路.某课题组在无氧环境中,用某腌制厂中含NO3-的废水对上述磷酸盐还原系统的除磷效率进行实验分析.
某文献报道可将ASBBR(一种生物膜反应器)用在有PO43-存在的环境中除磷,有一类微生物可在其中将PO43-还原为PH3,这项研究为解决含磷污染物的净化问题提供了新思路.某课题组在无氧环境中,用某腌制厂中含NO3-的废水对上述磷酸盐还原系统的除磷效率进行实验分析.