题目内容
10.下列说法正确的是( )| A. | 常温下,C(s)+H2O(g)?CO(g)+H2(g)不能自发进行,则该反应的△H<0 | |
| B. | 合成氨反应中使用高效催化剂可提高原料转化率 | |
| C. | 电解冶炼铝时需定期更换阳极的石墨电极 | |
| D. | 25℃时,向0.1 mol•L-1 CH3COOH溶液中加水稀释,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 |
分析 A.当△G=△H-T•△S<0时反应自发进行,据此进行判断;
B.催化剂不影响化学平衡,则不会提高原料的利用率;
C.电解冶炼铝时阳极碳不断被电解生成的氧气消耗,需定期更换;
D.稀释过程中醋酸的物质的量逐渐减小,醋酸根离子的浓度逐渐增大,则该比值逐渐减小.
解答 解:A.C(s)+H2O(g)?CO(g)+H2(g)为气体体积增大的反应,其熵变△S>0,该反应在常温下不能自发进行,则△G=△H-T•△S>0,该反应的△H>0,故A错误;
B.合成氨反应为可逆反应,使用高效催化剂可以改变反应速率,但是不会影响化学平衡,则不肯提高原料转化率,故B错误;
C.由于电解过程中,电解槽的阳极产生氧气,碳单质会与阳极产生的氧气反应而不断减少,所以电解过程中需定期向电解槽池中加入炭块,故C正确;
D.25℃时,向0.1 mol•L-1 CH3COOH溶液中加水稀释,醋酸的电离程度逐渐增大,则醋酸的浓度逐渐减小,醋酸根离子的浓度逐渐增大,由于在同一溶液中,则$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的比值逐渐减小,故D错误;
故选C.
点评 本题考查较为综合,涉及反应热与焓变、化学反应速率的影响、电解池工作原理等知识,题目难度中等,明确化学反应与能量变化的关系为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.新型Na-CO2电池工作原理为:4Na+3CO2═2Na2CO3+C,下列说法正确的是( )
| A. | Na是氧化剂 | B. | CO2在反应中失去电子 | ||
| C. | CO2全部被还原 | D. | 每生成1 molNa2CO3转移2 mol电子 |
2.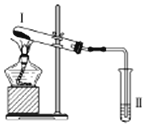 按如图装置进行实验,下列推断正确的是( )
按如图装置进行实验,下列推断正确的是( )
 按如图装置进行实验,下列推断正确的是( )
按如图装置进行实验,下列推断正确的是( )| 选项 | I中试剂 | II中试剂及现象 | 推 断 |
| A | 铁粉与湿棉花 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
| B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
| C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油分解产物中含有不饱和烃 |
| D | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
| A. | A | B. | B | C. | C | D. | D |
10.化学与能源开发、环境保护、资源利用、生产生活密切相关.下列说法错误的是( )
| A. | SO2是大气污染物,但葡萄酒中都含有一定量的SO2,SO2既可杀菌又可用来保鲜 | |
| B. | 绿色化学的核心是在化学合成中将原子充分利用,从源头上减少或消除污染 | |
| C. | 茂密树林中的道道光柱,既是一种自然现象又是光学现象,与胶体知识也有关系 | |
| D. | 研发使用高效催化剂,可提高反应中原料的转化率 |
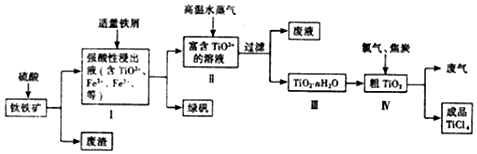

 ;D
;D
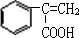 +CH3OH$→_{△}^{浓硫酸}$
+CH3OH$→_{△}^{浓硫酸}$ +H2O.
+H2O. 为原料合成重要的化工产品
为原料合成重要的化工产品 的路线流程图(无机试剂任选)
的路线流程图(无机试剂任选)
