题目内容
3.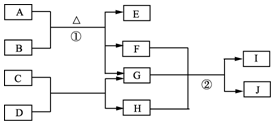 有关物质的转化关系如图1所示.A是黑色非金属单质,C、E、F均为氧化物,E、F常温下呈气态,且E能使品红褪色,G是一种常见的无色液体,I是一种难溶于水的白色胶状沉淀,能溶于B溶液.请回答下列问题:
有关物质的转化关系如图1所示.A是黑色非金属单质,C、E、F均为氧化物,E、F常温下呈气态,且E能使品红褪色,G是一种常见的无色液体,I是一种难溶于水的白色胶状沉淀,能溶于B溶液.请回答下列问题:(1)C的化学式为Al2O3.
(2)G的电子式为
 .
.(3)写出①反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(4)写出过量的F参加反应时②的离子方程式:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-.
分析 G是一种常见的无色液体,则应为H2O,E、F常温下呈气态,且E能使品红褪色,则E应为SO2,又A是黑色非金属单质,所以A为C,B为浓硫酸,F为CO2,反应①为C与浓硫酸在加热条件下发生反应生成二氧化碳、二氧化硫和水;I是一种难溶于水的白色胶状沉淀,能溶于B溶液,常见I为Al(OH)3,则H为NaAlO2,由转化关系及C为氧化物可知C为Al2O3,D为NaOH,以此解答该题.
解答 解:(1)根据以上分析,C的化学式为Al2O3,故答案为:Al2O3;
(2)根据以上分析,G是H2O,则G的电子式为 ,故答案为:
,故答案为: ;
;
(3)根据以上分析,反应①为C与浓硫酸在加热条件下发生反应生成二氧化碳、二氧化硫和水,则反应的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(4)根据以上分析,反应②为过量的二氧化碳通入NaAlO2溶液中发生反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-.
点评 本题考查无机物的推断,为高考常见题型,侧重考查学生的分析能力,题目主要涉及铝及其化合物性质,S、Al及其化合物性质的分析应用,注意反应特征的理解应用是解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.下列解释事实的离子方程式正确的是( )
| A. | SO2通入Ba(NO3)2溶液中有白色沉淀:SO2+Ba2++H2O═BaSO3↓+2H+ | |
| B. | 0.1mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| C. | “84”消毒液和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:ClO3-+Cl-+6H+═Cl2+3H2O | |
| D. | 氯化铁溶液中滴加氢硫酸溶液:2Fe3++S2-═2Fe2++S↓ |
11.下列气体不能用排空气法收集的是( )
| A. | NH3 | B. | SO2 | C. | NO | D. | H2 |
18.新型Na-CO2电池工作原理为:4Na+3CO2═2Na2CO3+C,下列说法正确的是( )
| A. | Na是氧化剂 | B. | CO2在反应中失去电子 | ||
| C. | CO2全部被还原 | D. | 每生成1 molNa2CO3转移2 mol电子 |
8.用 NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 密闭容器中,2mol SO2和1mol O2充分反应,生成SO3的分子数为2 NA | |
| B. | 1L1 mol•L-1 的(NH4)2SO4 溶液中含有的 NH4+数目为2NA | |
| C. | 足量的 MnO2与 100ml 12 mol•L-1的浓盐酸充分反应,转移的电子数目为 0.6 NA | |
| D. | 常温常压下,18 mL 水含有的分子数目约为 NA |
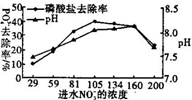 某文献报道可将ASBBR(一种生物膜反应器)用在有PO43-存在的环境中除磷,有一类微生物可在其中将PO43-还原为PH3,这项研究为解决含磷污染物的净化问题提供了新思路.某课题组在无氧环境中,用某腌制厂中含NO3-的废水对上述磷酸盐还原系统的除磷效率进行实验分析.
某文献报道可将ASBBR(一种生物膜反应器)用在有PO43-存在的环境中除磷,有一类微生物可在其中将PO43-还原为PH3,这项研究为解决含磷污染物的净化问题提供了新思路.某课题组在无氧环境中,用某腌制厂中含NO3-的废水对上述磷酸盐还原系统的除磷效率进行实验分析.