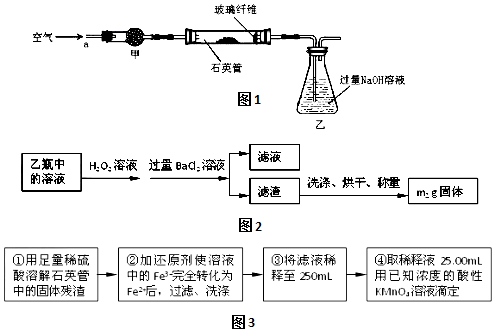
题目内容
5. (1)下列反应中,属于吸热反应的是④⑤⑦.
(1)下列反应中,属于吸热反应的是④⑤⑦.①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤Ba(OH)2•8H2O与NH4Cl反应 ⑥铁粉与稀盐酸反应 ⑦煅烧石灰石(主要成分是CaCO3)制生石灰(CaO) ⑧生石灰与水作用制熟石灰 ⑨食物因氧化而腐败.
(2)已知反应:
①N2(g)+O2(g)═2NO(g)△H1 ②2H2(g)+O2(g)═2H2O(g)△H2
③N2(g)+3H2(g)═2NH3(g)△H3 利用上述三个反应,计算4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H4的反应焓变为2△H1+3△H2-2△H3 (用含△H1、△H2、△H3的式子表示).
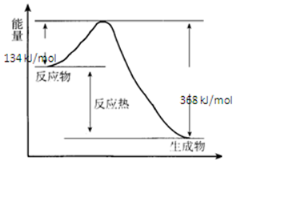
(3)在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如图所示.
①该反应是放热 (填“吸热”或“放热”)反应.
②该反应的热化学方程式为NO2(g)+CO(g)$\frac{\underline{\;\;\;400℃\;\;\;}}{101kPa}$NO(g)+CO2(g)△H=-234 kJ•mol-1;.
③改变下列条件都可使该反应的反应速率改变,其中通过降低活化能加快反应速率的是d.
a.浓度b.压强c.温度d.催化剂
④反应体系中加入催化剂对反应热是否有影响?否 (填“是”或“否”),原因是催化剂只能改变化学反应的速率和途径,不能改变化学反应始态和终态的能量,因此对反应热没有影响.
分析 (1)常见的吸热反应有:绝大多数的分解反应;以C、氢气和CO为还原剂的氧化还原反应;铵盐和碱的反应,据此分析;
(2)由①N2(g)+O2(g)═2NO(g)△H1
②2H2(g)+O2(g)═2H2O(g)△H2
③N2(g)+3H2(g)═2NH3(g)△H3
结合盖斯定律可知,①×2+②×3-③×2可得4NH3(g)+5O2(g)═4NO(g)+6H2O(g),以此计算.
(3)①据图分析,反应物能量高于生成物;
②书写热化学方程式时注意标出物质的状态,并且注意△H是生成物和反应物的能量差;
③催化剂能降低反应的活化能;
④△H=生成物能量-反应物能量,与反应条件无关.
解答 解:(1)①物质燃烧是放热反应; ②炸药爆炸是放热反应; ③酸碱中和反应是放热反应; ④二氧化碳通过炽热的碳是吸热反应; ⑤Ba(OH)2•8H2O与NH4Cl反应是吸热反应; ⑥铁粉与稀盐酸反应是放热反应; ⑦煅烧石灰石(主要成分是CaCO3)制生石灰(CaO)是吸热反应; ⑧生石灰与水作用制熟石灰是放热反应; ⑨食物因氧化而腐败是放热反应.故答案为:④⑤⑦;
(2)N2(g)+O2(g)═2NO(g)△H1
②2H2(g)+O2(g)═2H2O(g)△H2
③N2(g)+3H2(g)═2NH3(g)△H3
结合盖斯定律可知,①×2+②×3-③×2可得4NH3(g)+5O2(g)═4NO(g)+6H2O(g),
则△H4=2△H1+3△H2-2△H3,
故答案为:2△H1+3△H2-2△H3.
(3)①据图分析,反应物能量高于生成物,反应放热,故答案为:放热;
②△H=生成物与反应物能量差=134KJ/mol-368KJ/mol=-234KJ/mol,其热化学方程式为:NO2(g)+CO(g)$\frac{\underline{\;\;\;400℃\;\;\;}}{101kPa}$NO(g)+CO2(g)△H=-234 kJ•mol-1
故答案为:NO2(g)+CO(g)$\frac{\underline{\;\;\;400℃\;\;\;}}{101kPa}$NO(g)+CO2(g)△H=-234 kJ•mol-1;
③催化剂能降低反应的活化能,浓度、压强通过增大活化分子的浓度加快反应速率,温度是增大活化分子百分数增大反应速率,故选:d;
④应体系中加催化剂,对反应热没有影响,因为,催化剂只能改变化学反应的速率和途径,不能改变化学反应始态和终态的能量,因此对反应热没有影响,故答案为:否;催化剂只能改变化学反应的速率和途径,不能改变化学反应始态和终态的能量,因此对反应热没有影响.
点评 本题根据反应物键能和生成物键能解答问题以及盖斯定律的应用,考查内容比较基础,题目难度不大.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案| A. | 铁和稀硝酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 铝与氢氧化钠溶液反应:Al+OH-═AlO2-+H2↑ | |
| C. | 醋酸跟碳酸氢钠溶液反应:HCO3-+H+═CO2↑+H2O | |
| D. | 氯气和水反应:Cl2+H2O═H++Cl-+HClO |
| A. | 1.0L 1.0mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 常温常压下,24gNO2中所含的氧原子数为0.5NA | |
| C. | 常温常压下,11.2LCl2与足量Fe反应,转移电子数为NA | |
| D. | 1mol的羟基与1mol的氢氧根离子所含质子数均为9NA |
| A. | SO2通入Ba(NO3)2溶液中有白色沉淀:SO2+Ba2++H2O═BaSO3↓+2H+ | |
| B. | 0.1mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| C. | “84”消毒液和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:ClO3-+Cl-+6H+═Cl2+3H2O | |
| D. | 氯化铁溶液中滴加氢硫酸溶液:2Fe3++S2-═2Fe2++S↓ |
 .
.