题目内容
1. 煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1.
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度/℃ | 250 | 300 | 350 |
| K/L2•mol-2 | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为250℃,则反应速率v(H2)=0.4 mol•L-1•min-1.
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)?CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的$\frac{1}{2}$,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇).
分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,根据燃烧热的概念分别写出CO、甲醇燃烧的热化学方程式,然后利用盖斯定律写出甲醇不完全燃烧生成CO和液态水的热化学方程式;
(2)①升高温度,可逆反应向吸热反应方向移动,根据平衡常数与温度变化关系确定焓变;
②根据平衡浓度计算出平衡常数来确定温度;根据v=$\frac{△c}{△t}$计算反应速率;
(3)若在t1时刻将容器的体积缩小一倍,相当于增大压强,各组分的浓度立即增加原来的一倍,然后是平衡开始正向移动.
解答 解:(1)CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
氢气燃烧的热化学方程式为:①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1,
甲醇燃烧的热化学方程式为:②CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1,
由盖斯定律可知,②-①可得甲醇不完全燃烧生成CO和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2 H2O(l),△H=-726.5kJ•mol-1-(-283.0kJ•mol-1)=-443.5kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
(2)①升高温度,平衡向吸热方向移动,根据表格知,温度越高,化学平衡常数越小,说明平衡向逆反应方向移动,所以正反应是放热反应,即△H<0,
故答案为:<;
②CO(g)+2H2(g)?CH3OH(g)单位为mol/L
反应开始 1mol/L 3mol/L 0
反应 0.8mol/L 1.6mol/L 0.8mol/L
平衡 0.2mol/L 1.4mol/L 0.8mol/L
平衡常数K=$\frac{0.8}{0.2×1.{4}^{2}}$=2.04,所以是250℃;反应速率v(H2)=$\frac{1.6mol/L}{4min}$=0.4 mol•L-1•min-1,
故答案为:250℃;0.4 mol•L-1•min-1;
(3)若在t1时刻将容器的体积缩小一倍,相当于增大压强,各组分的浓度立即增加原来的一倍,然后是平衡开始正向移动,至新平衡,图示如下:
假定在t2时刻后又达到新的平衡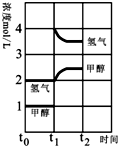 ;
;
故答案为: .
.
点评 本题考查了影响化学平衡移动的因素、速率的计算、热化学方程式盖斯定律应用等知识点,综合性强,难度大.

| A. | 由于分子中氢原子数:H2SO4>HClO4,故酸性:H2SO4>HClO4 | |
| B. | 由子F元素的最低化合价为-1价,故F元素的最高化合价为+7价 | |
| C. | 硅处于金属与非金属的过渡位置,故硅可用作半导体材枓 | |
| D. | Cl-、S2-、Ca2+、K+半径逐渐减小 |
 汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:
汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.
(1)写出CO2的结构式O=C=O,N2的电子式
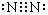 .
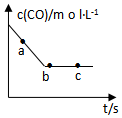
.(2)一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如图所示:
①则反应速率υ(a)、υ(b)、υ(c)的大小关系是υ(a)>υ(b)=υ(c);
②下列可说明反应到达图中c点的是BC;
A.NO、CO、CO2、N2的浓度比值保持2:2:2:1不变
B.CO的浓度不再改变
C.反应消耗2molNO的同时消耗1molN2
D.容器中的气体质量或物质的量保持不变
(3)为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
【资料查阅】
A.不同的催化剂对同一反应的催化效率不同;
B.使用等质量相同的催化剂时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g | 达平衡时所用的时间min |
| Ⅰ | 参照实验 | 280 | 6.50×10-3 | 4.00×10-3 | 80 | t |
| Ⅱ | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
| Ⅲ | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
②课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是温度,且升高温度反应速率将增大.(填“增大”、“减小”、“无影响”).
| 实验编号 | 实验前温度/℃ | 实验后温度/℃ |
| ① | 24.8 | 33.8 |
| ② | 24.7 | 33.7 |
| ③ | 24.9 | 35.9 |
②写出碳完全燃烧的热化学方程式:C(s)+O2(g)=CO2(g)△H=-376.2KJ/mol.
| A. | 金属Na着火,立即用水扑灭 | |
| B. | 做蒸馏实验时,应使温度计水银球位于蒸馏烧瓶支管口处 | |
| C. | 衣服沾上大量浓氢氧化钠溶液,需将此衣服浸泡在盛水的盆中 | |
| D. | 测试某溶液的pH时,先用水润湿pH试纸,再将待测液滴到pH试纸上 |
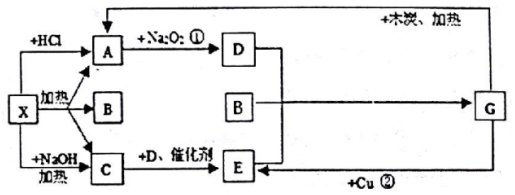
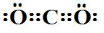 ;G的化学式为HNO3.
;G的化学式为HNO3. 碳元素形成的单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔触的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图所示,该物质的化学式为KC8.
碳元素形成的单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔触的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图所示,该物质的化学式为KC8.
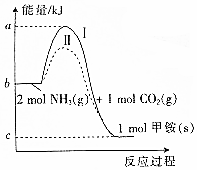 氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2与NH3反应生成甲铵的能量变化如图所示.
氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2与NH3反应生成甲铵的能量变化如图所示.